Uurige välja, mis on AATOMINUMBER
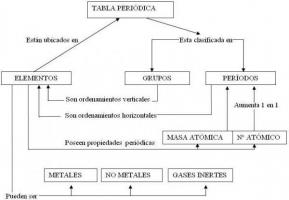
Mateeria koosneb aatomitest erinevatest keemilistest elementidest. Keemilistel elementidel on erinevad omadused ja omadused, mis neid üksteisest eristavad ja kahtlemata on üks olulisemaid aatomnumber. Aatomnumber, mida tavaliselt tähistab täht "Z", tähistab teatud aatomi prootonite arvu. Sama elemendi aatomitel on sama aatomnumber, samal ajal kui erinevate elementide aatomitel on alati erinevad aatominumbrid.
Kui olete kunagi mõelnud mis on aatomnumberKutsume teid jätkama selle PROFESSORI õppetunni lugemist, et teada saada selle määratlust, aga ka selle mõju aatomitele.
Indeks
- Aatominumber: lihtne määratlus
- Aatomnumber ja elemendid
- Perioodilise tabeli ja aatomnumbri suhe
- Elementide aatomnumber ja neutraalsus
Aatominumber: lihtne määratlus.
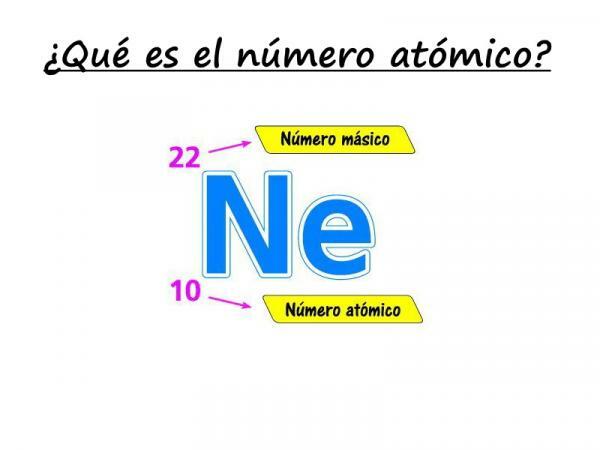
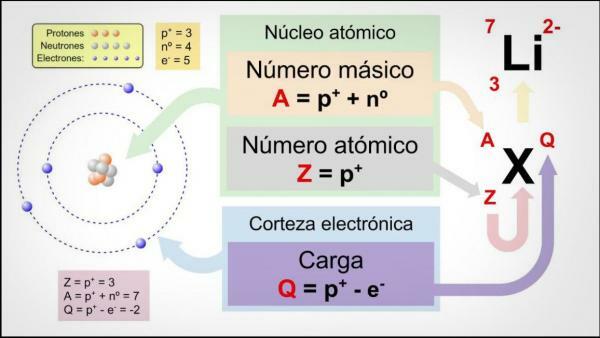
Kui soovite teada saada, mis on aatomnumber, pöörake tähelepanu meie selgitusele! Aatomnumber on prootonite arv, millest moodustub aatomi arv teatud elemendist. Tavaliselt tähistab seda täht "Z" (alati suurtähtedega), mis tuleneb saksakeelsest sõnast zahl, mis tähendab numbrit.
Pidagem meeles, et aatomi sees on klassikaliselt kolme tüüpi osakesi: prootonid, neutronid ja elektronid. Tuumas on prootonid ja neutronid, mille aatomi mass on suurim. Seetõttu annab aatomnumbri Z ja neutronite N summa summa aatomi massinumbri A.
Mõnikord võib looduses leida aatomeid, millel on sama aatomnumber (Z), kuid erinev neutronite arv (N) ja seetõttu erinev aatomimass. Neid aatomeid tuntakse kui isotoopid. Kui soovite rohkem teada saada Isotoopide omadused saate uurida meie õppetundi sellel teemal.
Aatomnumbril on palju rakendusi füüsikas ja keemias. Järgmistes jaotistes näeme lisaks peamisele kasulikkusele, milleks füüsikud ja keemikud on aatominumbrit kasutanud.
Pilt: määratlus
Aatomnumber ja elemendid.
Nüüd, kui me teame, mis on aatomnumber, vaatame selle kasutamist. The peamine utiliit füüsikalises ja keemilises aatomnumbris on määratleda sama elemendi aatomid. See on nii oluline, et uute elementide otsimine toimub tavaliselt aatomnumbrite abil.
Aatomil võib olla sama arv elektrone kui teisel ja see ei tohi olla sama elemendi aatomid. Teisalt, kui kahe aatomi aatomnumber on sama, kuuluvad mõlemad aatomid tingimata sama elemendi aatomiteks.
Aatomid, puhtal looduslikul kujul keemiliste elementidena, nad on selles neutraalses olukorras. Seetõttu on kvantmehaanika põhimõtete kohaselt prootonite arv tuumas aatom, mis määrab elektronide arvu, mida ta suudab hoida oma orbitaalides, mis ümbritsevad tuum. Elektronide, eriti kõige valentsema kesta arv on nende keemilise sidumise käitumise määramisel peamine tegur.
Seetõttu on aatomnumber asjaolu, et määrab keemilised omadused elemendi kohta. Sel põhjusel saab elementi määratleda ühtsena, kui meil on antud aatominumbriga aatomite segu.

Pilt: 100Cia.site
Perioodilise tabeli ja aatomnumbri suhe.
Nagu me varem nägime, määrab tuumas olev prootonite aatomnumber või -arv tegelikult selle elektronide arvu, mis teatud aatomil võivad olla. Sellepärast määrab kaudselt aatomnumber järjestuse perioodilisustabeli elemendid.
Kui olete kunagi pidanud perioodiliste elementide tabeli uurimisega silmitsi seisma, võite olla endalt küsinud, milliseid kriteeriume nad nende elementide tellimisel järgisid? Kas need on juhuslikult tellitud? Võib-olla vastavalt nende avastamise järjekorrale? Noh, ei, need on paigutatud vastavalt täitmise järjekorrale elektroonilised orbitaalid.
Nagu me varem nägime, määrab aatomnumber lõpuks aatomil olevate elektronide arvu. Seetõttu määratleb aatomnumber aatomi elektronkonfiguratsioon. Seetõttu võimaldab aatomnumber kaudselt tabelis järjestada erinevaid keemilisi elemente perioodiline, mis algab vesinikust (Z = 1) ja jätkub heeliumiga (Z = 2), liitiumiga (Z = 3), berülliumiga (Z = 4), booriga (Z = 5), süsinikuga (Z = 6) jne.

Pilt: Pinterest
Elementide aatomnumber ja neutraalsus.
Tavaliselt keemilised elemendid on tavaliselt väljendatud neutraalsed aatomid või molekulid aga nad ei pea alati olema. Mõnikord on mõnel aatomil või molekulil rohkem või vähem elektrone kui peaks. Juhul, kui aatomil või molekulil on vajalikud elektronid ja tal pole elektrilaengut (elektriliselt neutraalne), aatomnumber võrdub aatomi elektronide arvuga, mida võib leida aatomi ümber Ajukoor.
Muudel juhtudel võib aatomitel olla suurem elektronide arv, kui nende aatomite arv neile vastab, ja nad on paljude negatiivselt laetud. Neid nimetatakse anioonid. Vastasel juhul on elektronide arv aatomis või molekulis väiksem kui aatomi arv ja nad on positiivselt laetud. Oleksime katiooni ees.
Need elektronid määravad peamiselt aatomi keemiline käitumine ja need on väga olulised, et määrata kindlaks, kuidas erinevad aatomid või molekulid on omavahel seotud.
Kui soovite lugeda rohkem artikleid, mis on sarnased Mis on aatomnumber, soovitame sisestada meie kategooria Aatom.
Bibliograafia
- Tuumaenergia (20. mai 2019) aatominumber. Taastunud https://energia-nuclear.net/que-es-la-energia-nuclear/atomo/numero-atomico
- Recio Miñarro, J. (s.f) aatomnumber ja massinumber. Taastunud http://newton.cnice.mec.es/materiales_didacticos/el_atomo/zya.htm? 4&0
- Vikipeedia (25. jaanuar 2020) Aatominumber. Taastunud https://es.wikipedia.org/wiki/N%C3%BAmero_at%C3%B3mico