Mis on KEEMILISED VALEMID ja milleks need on mõeldud [KOKKUVÕTE + VIDEOD]
Kuigi ei paista, perioodilisuse tabeli keemilised elemendid Nad ümbritsevad meid igast küljest. Sageli ei leidu neid aga eraldi, vaid moodustavad erinevate keemiliste elementide molekule või makromolekule. Keemilised valemid on nende ühendite graafiline väljendus ja neid kasutatakse nende nomenklatuuri standardiseerimiseks. Selles ÕPETAJA õppetunnis näeme mis on keemilised valemid ja milleks need on. Liituge meiega, et rohkem teada saada!
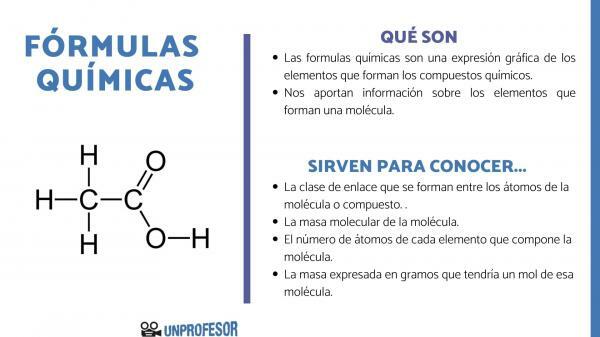
The keemilised valemid on graafiline väljendus elementidest, mis moodustavad keemilised ühendid.
Need keemilised valemid ei ole meelevaldsed, vaid järgivad mõnda ranged reeglid poolt kehtestatud keemianomenklatuuri IUPAC (Rahvusvaheline Puhta ja Rakenduskeemia Liit).
Keemilised valemid annavad meile ka teavet selle kohta elemendid, mis moodustavad molekuli, seega ütleb see meile näiteks iga selle moodustava aatomi arvu ja vastavad proportsioonid ning mõnikord isegi aatomi tüübi. Keemiline side mis eksisteerib nende elementide vahel.
Iga molekul või makromolekul, mis eksisteerib, vastab selle keemilisele valemile, olenemata sellest, kuidas see on
erinevat tüüpi valemid. Kõik need tüübid annavad meile molekuli kohta erinevat teavet, kuid kõik aitavad meil seda mõista keemiline olemus ja see aitab meil mõista, mis keemilistes reaktsioonides toimub ja kuidas üks ühend võib muutuda teisteks.Kuid selle keemianomenklatuuri mõistmiseks on vaja teatud teadmisi keemiast, kuna nad järgivad üsna spetsiifilist tehnilist keelt.

Pilt: Slaidimängija
The keemilised valemid on esindatud keemiliste sümbolite liit, koos iga aatomi vastava tähega, nagu see on perioodilisustabelja alaindeksid, mis on arvud, mis tähistavad nende arvu aatomid molekulis
Keemias (nii orgaanilises kui anorgaanilises) on teatud fragmendid või ühendid, mis näitavad teatud kordumist nii struktuurselt kui ka funktsionaalselt ning on identifitseeritud nimede järgi spetsiifiline. Kui nendel fragmentidel on vabu elektrone, mida ei jagata, nimetatakse neid radikaalideks ja need on ebastabiilsed, väga reaktiivsed ühendid, millel on lühike poolväärtusaeg.
Radikaalide näited on metüülrühmad CH3, nitraadirühmad NO3hüdroksüülrühmad OH- või radikaal Cl-. Neid tuntakse aga funktsionaalrühmadena, kui need on ahelaga seotud aatomid või aatomite rühmad süsinikdioksiid (mitmesuguse süsinikuga) ja mis vastutavad reaktsioonivõime ja keemiliste omaduste eest molekulid.
Need rühmad on eriti olulised orgaanilises keemias (inimese biomolekulid on põhiliselt süsinik ja vesinik). Mõned näited funktsionaalrühmadest on karbonüülrühm = C = O või karboksüülrühm -COOH.

Pilt: Monogramas.com
Nagu me ütlesime, keemilisi valemeid on mitut tüüpi. Kõik need valemid annavad meile erinevat tüüpi teavet molekulide kohta ja seetõttu see teenib konkreetset eesmärki, ilma et ükski valem oleks üldiselt teisest parem või halvem.
Eristatavad keemiliste valemite klassid on järgmised:
Empiirilised valemid
Empiirilised valemid on kõige lihtsamad valemid keemilise molekuli tähistamiseks, mõnikord öeldes, et need on minimaalsed valemid. Need valemid näitavad molekuli iga elemendi aatomite osakaalu, mis on lihtsustatud täisarvudeks, alati väikseimaks. Selle valemi näide on CH3 (metüülrühm), millel on kolm vesinikuaatomit ja üks süsinikuaatom.
Kuid need valemid võivad mõnikord tekitada valearusaamu molekuli koostise kohta. See juhtub siis, kui valem ei näita tegelikku aatomite arvu molekulis, nagu peroksiidi puhul vesinik, mille empiiriline valem on HO, kui valem peaks olema H2O2 (kaks vesinikuaatomit ja kaks hapnik). See toimub seega nomenklatuurikokkuleppe kaudu, kuna mõlemad alamindeksid on võrdsed, need on lihtsustatud.
Mõnda ühendit saab aga esitada ainult empiiriliste valemitega, kuna need koosnevad ioonivõrkudest. See esineb näiteks keedusoolas või naatriumkloriidis, mida tähistatakse kui NaCl, mis näitab, et iga naatriumi puhul on kloor.
Molekulaarvalemid
Seda tüüpi valemid on üsna lihtsad, nad lihtsalt väljendavad kovalentses molekulis esinevate aatomite tüüpi ja nende arvu. Need on valemid, mis esitavad keemilisi elemente ja arvu lineaarselt (alaindeksi kujul. Seda tüüpi valemi näiteks on glükoosi nimetus C6H12O6, mis väljendab seda glükoosi. Glükoosi molekul koosneb kuuest süsinikuaatomist, kaheteistkümnest vesinikuaatomist ja kuuest aatomist hapnikku.
Molekulaarvalemeid kasutatakse laialdaselt, mõnikord öeldakse, et need on molekulide tõelised valemid. Paljudel juhtudel langevad need kokku empiiriliste valemitega, näiteks CO2 puhul.
Poolarenenud valemid
Poolarenenud valemid on teatud tüüpi valemid, mis sarnanevad molekulaarvalemitele, kuna need väljendavad ka molekuli moodustavaid aatomeid ja nende arvu, aga ka anda teavet keemiliste sidemete kohta (mida kujutavad aatomitevahelised jooned) ja seda moodustavate süsinikuaatomite vahelise sideme tüübi kohta (kui need on lihtsad, kaksik- või kolmekordne). Poolarenenud valem on kasulik molekuli moodustavate radikaalide ja selle keemilise struktuuri tuvastamiseks (süsiniku- ja vesinikuaatomite vahelised sidemed ei ole esindatud).
Glükoosi puhul on selle poolarenenud valem CH2OH - CHOH - CHOH - CHOH -CHOH - CHO ja nagu näha on süsiniku, vesiniku ja vesiniku aatomid. hapnik on samad, mis molekulivalemis (vastavalt kuus, kaksteist ja kuus) ja kõik üksiksidemed (ainult glükoosil on sidemed lihtne). Seetõttu on see valem keerulisem kui molekulaarvalem.
Poolarendatud valemeid nimetatakse mõnikord lühendatud ja need on ehk kõige laialdasemalt kasutatav valemiklass. kasutatakse eriti orgaanilises keemias, kuigi need ei võimalda meil jälgida molekulide tegelikku geomeetriat.
Väljatöötatud valem
Väljatöötatud valemid on veidi keerulisemad kui poolarendatud valemid. Seda tüüpi valemites on side ja iga aatomi asukoht molekulis esitatud Descartes'i tasapinnal, kuni kogu ühend on esindatud.
Struktuurivalem
Struktuurivalem on graafiline kujutis molekuli struktuurist ruumis, mis annab meile teavet aatomite järjestuse ja jaotuse kohta ruumis. Selles valemis on näidatud ka molekuli moodustavad keemilised sidemed ja kas need on ühe-, kahe- või kolmekordsed. Seetõttu on see valem see, mis annab meile molekuli kohta kõige rohkem teavet.
Seda tüüpi valemeid kasutatakse keemiamaailmas rohkem professionaalsel tasemel, kuna need võimaldavad palju selgemalt näha keemilisi reaktsioone või uute molekulide sünteesi.
Lewise valemid
Need on keerulised, väga spetsiifilised ja tehnilised valemid. Neid tuntakse ka kui Lewise diagramme või struktuure ja need on sarnased väljatöötatud molekulide valemitega, kuid Lisaks on näidatud elektronid, mida aatomid igas keemilises sidemes jagavad, mis varieeruvad sõltuvalt aatomite valentsist kaasatud.
Nendes valemites on aatomitevahelised sidemed kujutatud joontega (mis näitab ka, kas need on ühe-, kahe- või kolmekordsed) või täppide paariga. Üksikud elektronid või elektronid, mida side ei jaga, on kujutatud punktidega selle aatomi ümber, millele see vastab.

Pilt: Orgaaniline keemia
Valemite kirjutamisel viidatakse mõnikord kaoksüdatsiooni number elemendist (see on ioonsetes ühendites sagedane). Need on positiivsete ja negatiivsete arvude komplekt, mis lähevad seotud iga elemendiga.
- Oksüdatsiooninumbreid saab tõlgendada kui elektronide arv et element jagab kovalentset sidet või kandub üle ioonsidemes.
- Kui oksüdatsioonimärk aatomi kohal on negatiivne, tähendab, et see element püüab kinni elektronid ja selle kõrval olev arv on kinnipüütud elektronide arv. Seetõttu tähendab oksüdatsiooniaste -1, et element võtab vastu ühe elektroni, -2, mis võtab vastu kaks jne.
- Kui oksüdatsiooni märk on positiivne, aatom loovutab elektroni ja selle märgiga kaasnev arv on loobutud elektronide arv. Samamoodi tähendab oksüdatsiooniaste +1, et see annab ühe elektroni, +2, et see annab kaks jne.
See toimib enamasti ioonsed ühendid, kovalentsetes sidemetes, kuigi tõlgendus on sarnane, pole see sama, kuna need sidemed jagavad elektrone. Nendes ühendites räägime rohkem elektronegatiivsetest elementidest, mis tõmbavad rohkem elektroonipaari ja jäävad negatiivsema laenguga, olenevalt elektronide arvust, mida see ligi tõmbab. Seda võib näha Lewise valemid.
Kui soovite teada, mille jaoks keemilised valemid on mõeldud, peate arvestama, et see arv võimaldab meil mõnda neist saada molekuli teave, nagu nad on:
- The link klass mis moodustuvad molekuli või ühendi aatomite vahel. Need sidemed on tavaliselt kovalentsed, kui neis osalevad mittemetallilised ja ioonsed aatomid, kui need on metallilised ja mittemetallilised sidemed.
- The molekulmass molekulist.
- The aatomite arv iga elemendi, millest molekul koosneb. Mõnikord nimetatakse seda molekuli sajapikkuseks koostiseks.
- Mass väljendatuna grammi millel oleks üks mool sellest molekulist.
Ioonse ühendi, näiteks naatriumkloriidi või keedusoola puhul ei ole see rangelt õige rääkida molekulidest (kuigi vahel seda tehakse), et need kipuvad moodustama suuri agregaate ja makromolekulid. Sel juhul aitab ühendi valem näha, millised ioonid seda moodustavad ja millises koguses.



