Mihin kausitaulukko on tarkoitettu?
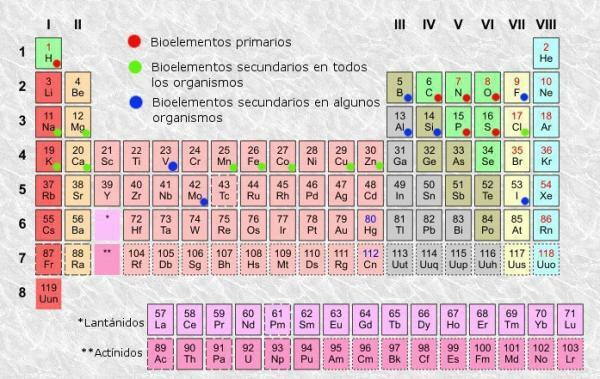
Jaksollinen taulukko on luokitusjärjestelmä atomielementeille, jonka keksi venäläinen kemisti vuonna 1869 Dmitri Mendelejev ja myöhemmin muut kemistit organisoivat ja päivittivät hänet ulkonäköönsä asti nykyinen. Huolimatta työkalusta, joka on osoittautunut hyödylliseksi koko historian ajan (siksi sitä on edelleen käytetty ja päivitetty), se on niin tylsiä oppia ja ymmärtää, minkä vuoksi olemme kaikki esittäneet itsellemme kysymyksen "Mitä pöytä on tarkoitettu? määräajoin? ".
Jos haluat tietää mikä on jaksollinen taulukko ja miksi on tärkeää ymmärtää sen ominaisuudet, jatka tämän opettajan opettamista.
Indeksi
- Jaksollisen taulukon luokitus
- Elementin nimen tai symbolin löytäminen jaksollisen taulukon avulla
- Tunne elementin atomimassa
- Tunne elementin atominumero
- Ennusta elementin atomisäde
- Vertaa kahden elementin ionisaatioenergiaa
- Kemiallisen elementin elektronegatiivisuuden löytäminen
- Vertaa kahden elementin elektroniaffiniteettia
Jaksollisen taulukon luokitus.
Kuten missä tahansa taulukossa, myös jaksollinen taulukko elementeistä voimme erottaa sarakkeet (pysty) ja rivit (vaaka). Jaksollisessa taulukossa on 18 saraketta tai ryhmää ja 7 riviä tai pistettä.
Lisäksi olet pystynyt varmistamaan, että normaalisti taulukon jokaisessa ruudussa näkyy ainakin seuraavat tiedot:
- Kemiallisten alkuaineiden symboli: lyhenteet tai merkit, joita käytetään elementtien tunnistamiseen. Ne koostuvat yleensä yhdestä tai kahdesta kirjaimesta, joista ensimmäinen on aina isoin kirjaimin.
- Kemiallisen elementin nimi: kemiallisen alkuaineen nimi, joka vastaa ylempää lyhennettä. Se on yleensä symbolin alapuolella.
- Atominumero: protonien kokonaismäärä, jotka kyseisen elementin jokaisella atomilla on. Se näkyy yleensä tuoteruudun vasemmassa yläkulmassa (tai täydellisempien taulukoiden oikeassa yläkulmassa).
- Atomimassa: atomin massaa voidaan normaalisti pitää protonien ja neutronien kokonaismassana yhdessä atomissa. Se on saatavana elementin nimen alapuolella yksinkertaisimmissa taulukoissa, vaikka toisissa se saattaa näkyä elementtiruudun oikeassa yläkulmassa.
On jaksollisia taulukoita, jotka sisältävät muita monimutkaisempia ja tarkempia tietoja, kuten hapettumistilat (hyödyllinen esimerkiksi kemiallisten yhdisteiden formuloinnissa), ionisaatioenergia, elektronegatiivisuus jne. anna tarpeeksi tietoa ja yleensä riittää keskivertokäyttäjälle, joka voi saada siitä tietoa, kuten kerromme alla.

Selvitä jakson taulukon avulla elementin nimi tai symboli.
Joskus tiedämme kemiallisten alkuaineiden symboli mutta emme tiedä hänen nimeään. Muina aikoina tiedämme kemiallisen alkuaineen nimi, mutta ei sen lyhennettä tai symbolia. Itse asiassa on hyvin helppoa, että tämä tapahtui sinulle koskaan luokassa.
Näissä tapauksissa voimme käyttää jaksollista taulukkoa ilman tarvetta sen olla monimutkainen ja tutkia puuttuvat tiedot nopeasti ja tarkasti.
Tunne elementin atomimassa.
Joskus tiedämme kemiallisen alkuaineen, josta olemme tekemisissä, mutta meidän on tiedettävä sen atomimassa, eli kuinka paljon kyseisen elementin atomi painaa.
Nämä tiedot ovat hyödyllisiä esimerkiksi seuraavia tehtäviä suoritettaessa:
- Laske aineen erityinen määrä.
- Analysoi testeissä tai kokeissa saadut tulokset.
- Laske massan prosenttiosuus.
- Ymmärrä monimutkaisten molekyylien tarkka moolimassa.
Tunne elementin atominumero.
Atomiluku on alkuaineen atomilla olevien protonien kokonaismäärä. Sähköisesti neutraalissa atomissa, muu kuin kationi (positiivisesti varautunut, yksi elektroni pienempi kuin normaalissa tilassa) tai anionin (negatiivisesti varautunut, yhdellä elektronilla enemmän kuin normaalissa tilassa), protonien lukumäärä on yhtä suuri kuin elektronit.
Protonien lukumäärä on ratkaiseva tekijä erottaessaan yhden elementin toisesta, koska elektronien tai neutronien lukumäärä ei muuta elementin tyyppiä.

Ennusta elementin atomisäde.
Atomisäde on puolet etäisyydestä kahden saman elementin keskellä, jotka tuskin koskettavat toisiaan. Tässä tapauksessa tiedä kemiallisen alkuaineen sijainti jaksollisessa taulukossa Se voi auttaa meitä selvittämään sen likimääräisen atomisäteen tai verrattuna toiseen elementtiin. Tätä varten meidän on tiedettävä se atomisäde:
- Se kasvaa, kun siirrymme jaksollisen taulukon ylhäältä alas.
- Se laskeutuu, kun siirrymme vasemmalta oikealle jaksollisen taulukon läpi.
Tällä tavalla kalsium on pienempi kuin rubidium, mutta suurempi kuin rauta.
Lisätietoja Mikä on atomisäde tämän toisen opettajan oppitunnin kanssa.
Vertaa kahden elementin ionisaatioenergiaa.
ionisaatioenergia on energia, jota tarvitaan elektronin poistamiseksi elementin atomista. Tässä tapauksessa, jos tiedämme kahden elementin sijainnin jaksollisessa taulukossa, voimme tietää, minkä elementin on helpompi "poistaa" elektroni. Meidän on vain otettava huomioon, että:
- Ionisointienergia vähenee, kun se liikkuu ylös ja alas jaksollisessa taulukossa.
- Ionisointienergia kasvaa, kun siirryt jaksollisen taulukon vasemmalta oikealle.
Berylliumin ja hapen välissä hapella on enemmän ionisaatioenergiaa. Jos verrataan happea ja rikkiä, jotka ovat samassa ryhmässä mutta seuraavalla jaksolla, hapella on myös suurempi ionisaatioenergia, koska se on korkeampi jaksollisessa taulukossa.
Etsi kemiallisen elementin elektronegatiivisuus.
Elektronegatiivisuus on atomin kyky houkutella elektroneja. Käytännössä tämä tarkoittaa kykyä muodostaa kemiallinen sidos. Jos haluat tietää, onko kemiallisella elementillä suuri kyky muodostaa kemiallinen sidos vai ei, meidän on otettava huomioon vain jaksollisessa taulukossa seuraava malli:
- Se laskeutuu liikkuessaan ylös ja alas.
- Se kasvaa, kun siirryt vasemmalta oikealle.
Kuten edellisessä tapauksessa, happi on enemmän elektronegatiivista kuin beryllium ja rikki, koska se on oikealla puolella ensimmäistä ja korkeampi kuin rikki.

Vertaa kahden elementin elektroniaffiniteettia.
Sähköinen suhde onko hän neutraalin atomin energiamuutos, kun se houkuttelee elektronia tulla negatiiviseksi ioniksi. Tällöin elektroninen affiniteetti ei vaihtele yhtä tarkasti kuin edellisissä tapauksissa, vaikka voimme sanoa, että yleensä elektroninen affiniteetti:
- Se nousee samalla ajanjaksolla vasemmalta oikealle.
- Nouse samassa ryhmässä alhaalta ylös.
Jos haluat lukea lisää artikkeleita, jotka ovat samanlaisia kuin Mikä on jaksollinen taulukko?, suosittelemme, että kirjoitat luokan Atomi.
Viitteet
Onko sinulla syötteitä tai kommentteja jaksollisen taulukon käytöstä? Jätä se vapaasti kommenttiosioon! Piditkö tästä artikkelista? Voit myös jättää luokituksen alle!

