MOLEKULAARINEN geometria: määritelmä ja esimerkkejä
kolmiulotteinen muoto jossa molekyylin muodostavat atomit ovat järjestetty, tunnetaan nimellä molekyyligeometria tai molekyylirakenne.
Teoreettisesta mallista on mahdollista päätellä näiden molekyylien geometria: valenssikuoren elektroniparien hylkimismalli (RPECV). Tämä malli on erityisen hyödyllinen edustamaan pienistä atomista koostuvien ja kovalenttisilla sidoksilla toisiinsa liitettyjen molekyylien geometriaa (elektronien jakaminen).
Tässä OPETTAJAN oppitunnissa löydämme molekyyligeometrian määrittely ja esimerkkejä Joten tällä tavalla voit oppia, mistä RPECV-malli koostuu, kuinka molekyylien geometria voidaan päätellä tällä menetelmällä ja joitain esimerkkejä.
Indeksi
- Määritelmä molekyyligeometria
- Esimerkkejä molekyyligeometriasta
- Tunne molekyylin Lewis-rakenne
- Valenssikuoren elektroniparin hylkimismalli (RPECV)
Määritelmä molekyyligeometria.
Molekyyligeometria tai molekyylirakenne on tapa atomien löysi molekyylin on järjestetty avaruuteen.
Tämä kolmiulotteinen rakenne (molekyyligeometria) tulee
määrittelee joukko voimia jotka pitävät atomeja yhdessä erityisessä järjestelyssä. Molekyyligeometrian määrittävät voimat ovat tärkeimpiä linkit että atomeja makaamaan toisilleen muodostavat molekyylin.Molekyylien geometria on erittäin tärkeä koska se määrittää aineen fysikaalis-kemialliset ominaisuudet. Esimerkiksi: H2O-molekyyleillä on kulmageometria, joka saadaan sen muodostavista sidoksista. Tämän kulmallisen geometrian omaksuminen tekee vesimolekyylistä sähköisen dipolin ja sillä on poikkeuksellisia ominaisuuksia. Geometriansa ansiosta vesi on nestemäistä huoneen lämpötilassa, se kykenee liuottamaan monia aineita jne.
Molekyylien koon vuoksi niiden geometriaa ei tietenkään voida tarkkailla suoraan, ja ne on pääteltävä epäsuorilla menetelmillä. Lisäksi on välttämätöntä esittää nämä geometriat teoreettisten mallien avulla.
Juuri näiden teoreettisten mallien avulla voimme määrittää molekyylin geometrian molekyylikaavasta.
Esimerkkejä molekyyligeometriasta.
Kuten olemme nähneet edellisessä osassa, molekyylin muodostavat atomit voivat hankkia erilaisia tilajärjestelyjä (geometrioita). Tässä osassa näemme joitain esimerkkejä molekyyligeometriasta.
Kaksiulotteinen geometria
Joissakin tapauksissa molekyylit hankkivat tasaisen tai kaksiulotteisen geometrian, toisin sanoen ne ovat rakenteita, joilla on vain kaksi ulottuvuutta ja jotka vievät pinnan (niillä ei ole tilavuutta).
Lineaarinen geometria
Se on yksinkertaisin geometria, se koskee molekyylejä, joiden atomit ovat liittyneet muodostamaan suoran viivan. Kaikki kahdesta atomista koostuvat molekyylit ovat lineaarisia, mutta tämä geometria esiintyy myös kolmesta atomista koostuvissa molekyyleissä.
Esimerkkejä lineaarisista molekyyleistä:
Muodostuu kahdesta atomista: kaikki piimatkaasut, kuten O2, H2.
Koostuu kolmesta atomista: CO2 (hiilidioksidi).
Kulmageometria
Ne ovat molekyylejä, jotka koostuvat kolmesta atomista, jotka tulevat yhteen kulmassa. Muodostuneen kulman amplitudi voi olla erilainen sen muodostavien atomien tyypistä riippuen. Kulmamolekyylien muodostamien kulmien amplitudien arvot ovat välillä 90º - 120º.
Esimerkkejä: H2O, SO2 (rikkidioksidi), SnCl2 (tinadikloridi)
Kolmion muotoinen geometria
Ne ovat molekyylejä, jotka koostuvat neljästä atomista, joista yksi atomi sijaitsee kuvitteellisen kolmion keskellä ja muut kolme muuta atomia sijaitsevat tämän kolmion kussakin kärjessä.
Esimerkkejä: SO3 (rikkitrioksidi), NO3- (nitraatti-ioni)
Neliön geometria
Tämän geometrian molekyyleillä on 5 atomia. Yksi sijaitsee neliön keskellä ja toinen 4 kuvan kussakin kärjessä.
Esimerkkejä: XeF4 (ksenonitrifluoridi)
Kolmiulotteinen geometria
Heillä on kolme ulottuvuutta, toisin sanoen heillä on tilavuus. 3D-molekyylien geometriat ovat hyvin erilaisia, tässä näemme vain muutamia esimerkkejä.
Tetraedrinen geometria
Tämä geometria on sellainen, jota jotkut viiden atomin muodostamat molekyylit esittävät, siinä atomi sijaitsee kuvitteellisen kuution keskipiste ja neljä jäljellä olevaa atomia sijaitsevat kuution (tetraedrin) kärjissä.
Esimerkki: CH4 (metaani), Mn04-(permanganaatti-ioni)
Trigonaalinen pyramidimainen geometria
Ne ovat molekyylejä, joissa on neljä atomia, jotka on järjestetty kolmionmuotoisen pyramidin neljään kärkeen.
Esimerkki: NH3 (ammoniakki), PH3 (fosfiini)
Nelikulmainen pyramidimainen geometria
Tässä tapauksessa molekyylin muodostavien atomien määrä on kuusi ja viisi niistä on järjestetty molekyyliin neliön pohjalla olevan pyramidin kärjet, kun taas kuudes sijaitsee neliön keskellä pohja.
Esimerkki: ClF5 (klooripentafluoridi)
Tunne molekyylin Lewis-rakenne.
Ennen kuin voit käyttää RPECV-menetelmä on tarpeen tietää, mikä se on Lewisin rakenne molekyylin ja tätä varten sinun on ensin tiedettävä mitä elektroninen kokoonpanoValencian kerroksesta molekyylin muodostavien atomien joukosta.
Siksi ennen molekyylin geometrian määrittämistä on suoritettava joitain edellisiä vaiheita:
- TO. Hanki elektronikonfiguraatiot molekyylin muodostavien atomien joukosta.
- B. Määritä valenssikuoren elektronien määrä kunkin atomin. Valenssikuoressa olevat elektronit ovat elektroneja, joita atomi voi käyttää sidosten muodostamiseen.
- C. Johda Lewisin rakenne ottaen huomioon, kuinka monta elektronia jokaisella atomilla on valenssikuoressaan.
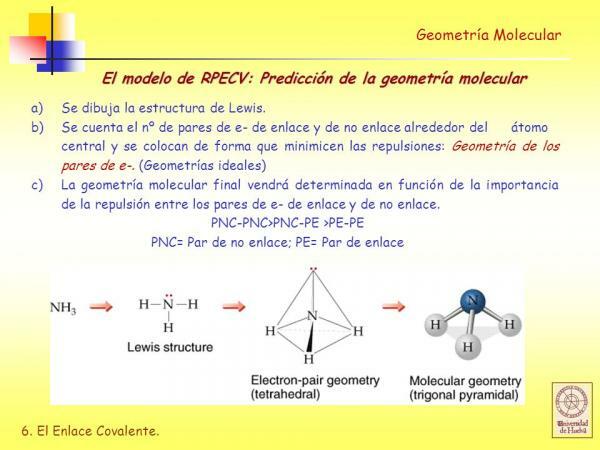
Kuva: Slideplayer
Valenssikuoren elektroniparin hylkimismalli (RPECV)
vuonna Lewis-rakenteet jokaisen sitoutuneen atomin on täytettävä oktetin sääntö. Kun atomi täyttää oktettisäännön, sitä ympäröi neljä elektroniparia, jotka voivat olla elektroneja, jotka ovat osa sidos (sitoutuvat elektroniparit) tai elektroniparit, jotka eivät osallistu sidoksen muodostumiseen (elektroniparit eivät sitova).
Kuten näemme, johda molekyylin Lewis-rakenne määritettyään geometria käyttäen valenssikuoren elektroniparien hylkimismallia on hyvin helppo.
Tämän esitysmallin mukaan ligandit (X) ja sitoutumattomat elektroniparit (E) on järjestetty keskiatomin (A) ympärille siten, että niiden välinen etäisyys on suurin. Ligandien ja sitoutumattomien elektroniparien (X + E) summa määrää molekyylin geometriatyypin.
X + E = 2
Lineaarinen geometria
AX2: Molekyyli, jonka muodostavat kaksi ligandiatomia, jotka ovat kiinnittyneet keskiatomiin
Esimerkki: berylliumhydridi (BeH2).
X + E = 3
Kolmion tasogeometria (tasasivuinen kolmio)
AX3: Molekyyli, joka koostuu kolmesta atomista, jotka ovat kiinnittyneet keskiatomiin
Esimerkkejä: Jotkut kloridit, kuten boori tai alumiini (BCl3, AlCl3)
Kulmageometria (120 asteen kulma)
AX2E: Molekyyli, jonka keskiatomi on kiinnittynyt kahteen ligandiin ja sitoutumaton elektronipari.
Esimerkkejä: Tina (II) kloridi (Sn2Cl)
X + E = 4
Tetraedrinen geometria
AX4: Molekyylit, joissa on keskiatomi ja neljä ligandia, jotka on järjestetty sidoksiin siten, että ligandit ovat heillä on vastakkaisten diagonaalien kärjissä kuutio, jonka keskusta on itse keskiatomi.
Esimerkit: Molekyylit, kuten metaani (CH4), piikloridi (SiCl4) tai hiilitetrakloridi (CC14), esittävät tämän geometrian.
Trigonaalinen pyramidigeometria
AX3E: Molekyylit, joissa on 3 ligandia ja yksi yksinäinen elektronipari, johon kolmen ligandin atomit on järjestetty muodostumaan pyramidin pohja, jossa on kolmiomainen pohja, jossa keskiatomi on mainitun yläosan kärjessä pyramidi
Esimerkkejä: yksi molekyyleistä, joilla on tämä geometria, on ammoniakki (NH3).
Kulmageometria (109 asteen kulma)
AX2E2: Kaksi ligandia ja keskiatomi on järjestetty muodostaen 109 asteen kulman
Esimerkkejä: Vesi (H2O) on yksi molekyyleistä, joilla on tämä geometria.
Glineaarinen eometria
AX3: Koska keskiatomiin on kiinnitetty vain yksi ligandi, geometria on lineaarinen.
Esimerkki: Fluorivety tai fluorivetyhappo (HF).
X + E = 5
Trigonaalinen bipyramidaalinen geometria
AX5: Molekyylillä on kahden vastakkaisen pyramidin geometria, molemmille yhteisen kolmion muotoisen pohjan kanssa. Keskiatomi on järjestetty keskelle ja ligandit sijaitsevat kärjissä.
Esimerkki: Fosforipentakloridi (PCl5)
Dyshenoidinen geometria
AX4E: Tämän tyyppisessä geometriassa atomit saavat järjestelyn, joka muistuttaa keinuvipu-keinun rakennetta.
Esimerkki: Tetra-rikkifluoridi (SF4).
T-geometria
AX3E2: Molekyylit ovat muodoltaan T-kirjaimen muotoisia, ligandit kirjaimen päissä ja keskiatomi kohdassa, jossa kaksi sen muodostavaa viivaa kohtaavat.
Esimerkki: Klooritrifluoridi (ClF3)
Lineaarinen geometria
AX2E3: Tässä tapauksessa molekyylin kolme atomia on järjestetty keskiatomin kanssa keskiasentoon.
Esimerkki: Ksenonidifluoridi (F2Xe)
X + E = 6
Oktaedrinen geometria
AX6: Tämän tyyppisellä molekyylillä on rakenne, joka muistuttaa oktaedonia, jossa keskiatomi vie geometrisen kuvan keskikohdan ja kuusi ligandia kussakin sen kärjessä.
Esimerkki: Rikkiheksafluoridi (SF6)
Neliön muotoinen pyramidi
AX5E: Tässä tapauksessa atomit muodostavat kuvan, jossa keskiatomi vie pohjan keskuksen ja ligandit kuvan viisi kärkeä.
Esimerkki: Bromipentafluoridi (BrF5)
Tason neliön geometria
AX4E2: Atomit saavat neliön muotoisen järjestelyn, jossa keskiatomi vie kuvan keskikohdan ja ligandit kumpikin sen kärjet.
Esimerkki: Ksenonitetrafluoridi-ioni (XeF4)

Jos haluat lukea lisää artikkeleita, jotka ovat samanlaisia kuin Molekyyligeometria: Määritelmä ja esimerkkejä, suosittelemme, että kirjoitat luokan Atomi.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Peruskemia. Madrid: Uned