JAKSOISTAULUKON ryhmien ominaisuudet
Kuva: Luonnontieteet
jaksollinen elementtitaulukko tilaa kaikki kemialliset alkuaineet toistaiseksi tunnettu. Vaikka saattaa tuntua toisin, nämä elementit on järjestetty noudattamalla varovaisia sääntöjä sen koosta reaktiivisuuteen, kulkemalla muiden ominaisuuksien, kuten viimeisen kuoren elektronien lukumäärän, läpi atomi.
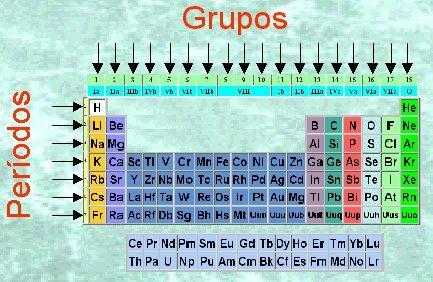
Jaksotaulukko on pohjimmiltaan taulukko, joka koostuu riveistä ja sarakkeista. Rivit, jotka on järjestetty muotoon vaakasuorassa, ns jaksoja samalla kun sarakkeita, vertikaalisesti, ovat ryhmät. Mutta mikä määrittää, että kaksi elementtiä on samassa ryhmässä tai eri ryhmässä? Tässä OPETTAJAN oppitunnissa näemme jaksollisen taulukon ryhmien ominaisuudet.
Indeksi
- Mitkä ovat jaksollisen taulukon ryhmät? Kuinka monta ryhmää on jaksollisessa taulukossa?
- Ryhmän 1 (IA) ominaisuudet
- Ryhmän 2 (IIA) ominaisuudet
- Ryhmien 3-12 (B) ominaisuudet
- Ryhmän 13 (IIIA) ominaisuudet
- Ryhmän 14 (alv) ominaisuudet
- Ryhmän 15 (VA) ominaisuudet
- Ryhmän 16 (VIA) ominaisuudet
- Ryhmän 17 (VIIA) ominaisuudet
- Ryhmän 18 (VIIIA) ominaisuudet
Mitkä ovat jaksollisen taulukon ryhmät? Kuinka monta ryhmää on jaksollisessa taulukossa?
Ennen kuin alamme puhua jaksollisen taulukon ryhmien ominaisuuksista, meidän on tiedettävä, mistä tämä järjestelmä koostuu. Tutkimalla tähän mennessä löydettyjä kemiallisia alkuaineita Mendelejev suunnitellut tämän mallin taulukossa: jaksollinen elementtitaulukko. Vaakasuorat rivit ja pystysarakkeet näkyvät jaksollisessa taulukossa. Jaksollisen taulukon sarakkeita kutsutaan ryhmiksi ja saman ryhmän elementeiksi (samassa sarakkeessa) on sama valenssi ja samanlaiset kemialliset ominaisuudet kuin seuraavassa osiot.
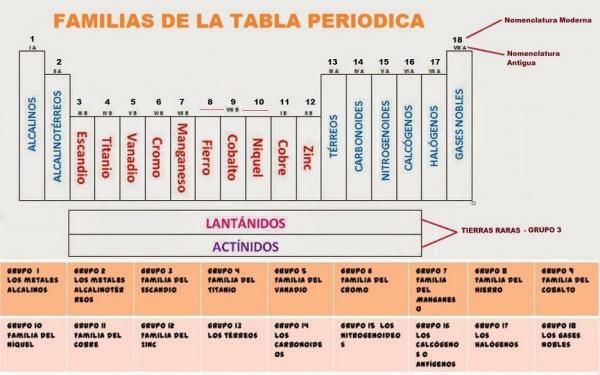
Tällä hetkellä jaksollinen taulukko on koostuu 18 ryhmästä. Kullekin ryhmälle on annettu koodi ja joissakin tapauksissa yleinen nimi.
18 jaksollisen taulukon ryhmää He ovat:
- Ryhmä 1, IA tai alkalimetallit. Koostuu litiumista (Li), natriumista (Na), kaliumista (K), rubidiumista (Rb), cesiumista (Cs) ja franciumista (Fr)
- Ryhmä 2, II A tai maa-alkalimetallit. Koostuu berylliumista (Be), magnesiumista (Mg), kalsiumista (Ca), strontiumista (Sr), bariumista (Ba) ja radiumista (Ra).
- Ryhmä 3, IIIB tai Escandio-perhe. Koostuu: Scandium (Sc), yttrium (Y), Lutetium (Lu), Lawrencio (Lr), Lanthanum (La), Actinium (Ac).
- Ryhmä 4, IV B tai Titanium-perhe. Se koostuu alkuaineista: titaani (Ti), zirkonium (Zr) ja hafnium (Hf) ja rutherfordium (Rf)
- Ryhmä 5, VB tai Vanadium-perhe. Tämä ryhmä koostuu alkuaineista: vanadium (V), niobium (Nb), tantaali (Ta) ja dubnium (Db).
- Ryhmä 6, VIB tai kromiperhe. Ryhmään 6 kuuluvat: kromi (Cr), molybdeeni (Mo), Wolfram tai volframi (W) ja Seaborgium (Sg).
- Ryhmä 7, VIIB tai mangaaniperhe. Ryhmä 7 koostuu seuraavista: mangaani (Mn), teknetium (Tc), renium (Re) ja Bohrio (Bh).
- Ryhmä 8, VIIIB tai rautaperhe. Ryhmään 8 kuuluvat: rauta (Fe), rutiini (Ru), Osmium (Os) ja Hassium (Hs).
- Ryhmä 9, IXB tai kobolttiperhe. Ryhmä 9 koostuu: koboltti (Co), rodium (Rh), Iridium (Ir) ja Meitnerium (Mt).
- Ryhmä 10, XB tai nikkeliperhe. Tämä ryhmä koostuu: nikkeli (Ni), palladium (Pd), platina (Pt) ja darmstadium (Ds) (aiemmin Ununnilio (Uun).
- Ryhmä 11, XIB, kupariperhe tai metallien lyöminen. Tähän ryhmään kuuluvat: Kupari (Cu), Hopea (Ag), Kulta (Au) ja Roentgenium (Rg).
- Ryhmä 12, XIIB tai sinkkiperhe. Ryhmä 12 koostuu sinkistä (Zn), kadmiumista (Cd), elohopeasta (Hg) ja kopernikiumista (Cn).
- Ryhmä 13, IIIA tai booriperhe. Muodostavat boori (B), alumiini (Al), gallium (Ga), indium (In), tallium (Tl) ja nihonium (Nh).
- Ryhmä 14, IVA, hiili- tai karbidiperhe. Ryhmä 14 koostuu alkuaineista: hiili (C), pii (Si), germanium (Ge), tina (Sn), lyijy (Pb) ja phlerovium (Fl).
- Ryhmä 15, V5, pnicógenos- tai typpioksidiperhe. Se koostuu typestä (N), fosforista (P), arseenista (As), antimonista (Sb), vismuttista (Bi) ja muscoviosta (Mc).
- Ryhmä 16, VIA, amfogeenit, kalkogeenit tai happiperhe. Sisältää: happi (O), rikki (S), seleeni (Se), Telluurium (Te), polonium (Po) ja Livermorio (Lv).
- Ryhmä 17, VIIA tai halogeenit. Tämä ryhmä koostuu: fluorista (F), kloorista (Cl), bromista (Br), jodista (I), astaatista (At) ja tenesista (Ts).
- Ryhmä 18, VIIIA tai jalokaasut. Ryhmän muodostavat: helium (He), neon (Ne), argon (Ar), krypton (Kr), ksenoni (Xe), radoni (Rn) ja oganesson (Og).
Kemiallisten alkuaineiden toinen luokitus
Kemiallisten alkuaineiden sisällä voimme löytää toisen luokituksen jaksollisen taulukon ryhmistä.
- Ryhmät 1, 2, 13, 14, 15, 16, 17 ja 18 kuuluvat pääelementtien tai ryhmien ryhmään A
- Ryhmät 3, 4, 5, 6, 7, 8, 9, 10, 11 ja 12 kuuluvat ryhmään B tai siirtymämetalleihin.
Suurin osa näistä kemiallisista alkuaineista löytyy luonnosta, joko puhtaina tai seoksina muiden yhdisteiden tai alkuaineiden kanssa. Toisaalta jotkut niistä, kuten myski, ovat keinotekoisia elementtejä, jotka ihminen on luonut laboratorioissa ja joita ei ole koskaan nähty luonnossa. Täältä löydämme sinut tarkemmin kuinka jaksollinen taulukko on järjestetty.
Kuva: Jaksolliset taulukot
Ryhmän 1 (IA) ominaisuudet.
Aloitamme analysoimalla jaksollisen taulukon ryhmien ominaisuuksia puhumalla ryhmän 1 elementit joilla on seuraava ominaisuudet:
- Hapetusluku +1. Siksi ne ovat erittäin sähköpositiivisia ja niillä on pieni ionisaatioenergia, koska ne menettävät helposti tämän elektronin.
- Elektroninen kokoonpano on ns1
- Ne ovat kemiallisesti reaktiivisimpia kemiallisia alkuaineita, ja siksi ne eivät luonnossa ole eristettyjä, vaan suolojen muodossa.
- Ne ovat pehmeitä, matalatiheyksisiä metalleja, joilla on matala sulamispiste. Kun ne leikataan tai sulatetaan, niiden hopean väri ja metallinen kiilto havaitaan.
- Ne ovat muokattavia, sitkeitä ja hyviä lämmön ja sähkön johtimia.
- Ne muodostavat hydroksideja reagoidessaan veden kanssa

Kuva: Slideshare
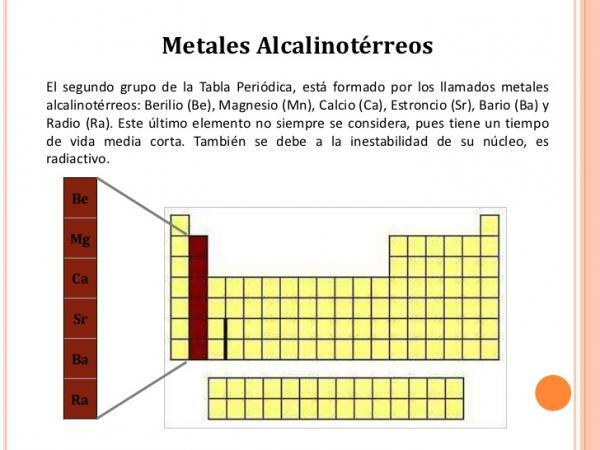
Ryhmän 2 (IIA) ominaisuudet.
ryhmän 2 elementit niillä on seuraavat ominaisuudet:
- Hapetusluku +2
- Elektroninen kokoonpano on ns2
- Alhainen ionisaatioenergia, jota tulee vähemmän ja vähemmän laskeutuessa ryhmään. Siksi kaikki, paitsi beryllium, muodostavat selvästi ionisia yhdisteitä.
- Ne reagoivat helposti halogeenien kanssa muodostaen ionisuoloja.
- Niillä on pieni tiheys ja ne ovat värillisiä ja pehmeitä
Kuva: Slideshare
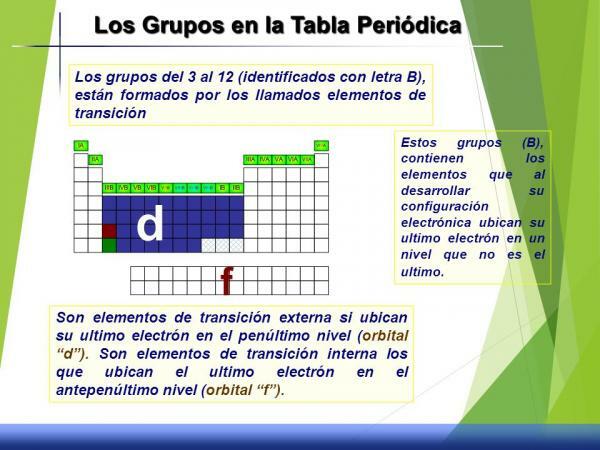
Ryhmien 3-12 (B) ominaisuudet.
Tätä ryhmäsarjaa kutsutaan siirtymämetallit tai lohko d koska, jos tarkastelemme sen elektronista konfiguraatiota, d-orbitaali on osittain täytetty elektronilla.
Heillä on välitöntä käyttäytymistä, toisin sanoen ilman hyvin reaktiivista he eivät ole kovin inerttejä (vähän reagoivat aineet), niillä ei ole tyypillisiä hapetustiloja tai tilaa, tiheyttä tai ominaisuuksia selvästi määritelty.
Kuva: Slideplayer
Ryhmän 13 (IIIA) ominaisuudet.
Ryhmä 13Huolimatta siitä, että se on myös ominaisuuksiltaan melko keskitasoinen, näemme, että se on jonkin verran tarkempi kuin edelliset. Ryhmän 13 elementeillä on:
- Heillä on hapettumistila +3 ja tietyissä alkuaineissa myös +1
- Ne ovat yleensä metalloideja, joiden sulamispiste on erittäin korkea
- Niillä on yleensä tyypillisiä ei-metallisia ominaisuuksia

Kuva: Slideshare
Ryhmän 14 (alv) ominaisuudet.
hiilidioksidielementit Ne ovat myös melko vaihtelevia ja niillä on hyvin erityinen ominaisuus: Kun menemme alas ryhmään, elementeillä on enemmän metallisia ominaisuuksia; hiili on ei-metallia, pii ja germanium ovat puolimetalleja, ja ryhmän alapuolella tina ja lyijy ovat metalleja.

Kuva: Slideserve
Ryhmän 15 (VA) ominaisuudet.
Jatkamalla jaksollisen taulukon ryhmien ominaisuuksia, puhumme nyt ryhmä 15 elementtiä:
- Ne ovat erittäin reaktiivisia korkeissa lämpötiloissa. Klassinen esimerkki on typen reaktio hapen ja vedyn kanssa, joka tapahtuu vain korkeassa lämpötilassa tai paineessa.
- Heillä on 5 valenssielektronia.
- Kovalenttisia sidoksia muodostuu yleensä N: n ja P: n välillä, ionisidoksia Sb: n ja Bi: n ja muiden alkuaineiden välillä.

Kuva: Slideplayer
Ryhmän 16 (VIA) ominaisuudet.
Ominaisuudet ryhmä 16 elementtiä He ovat:
- Heillä on kuusi valenssielektronia (viimeinen kuori s2s4)
- Sen ominaisuudet vaihtelevat ei-metallisista metallisiin, kun sen atomiluku kasvaa.
- Sen atomitilavuus, tiheys, anionin säde sekä sulamis- ja kiehumispisteet kasvavat, kun siirrymme alas ryhmästä.
- Sen ominaislämpö ja hydridin muodostumislämpö vähenevät, kun menemme alas ryhmässä.

Kuva: Slideplayer
Ryhmän 17 (VIIA) ominaisuudet.
Ominaisuudet ryhmä 17 tai halogeenit ovat seuraavat:
- Ne ovat yksiarvoisia elementtejä, toisin sanoen niillä on vain yksi valenssiluku. Halogeeneissa valenssi on -1.
- Ne yleensä yhdistyvät metallien kanssa muodostaen halideja, halideja tai hydridejä.
- Heillä on vähän affiniteettia happea kohtaan, joten ne eivät muodosta oksideja vaan hyvin korkeissa lämpötiloissa.

Kuva: Slideplayer
Ryhmän 18 (VIIIA) ominaisuudet.
Ja lopetamme tämän oppitunnin jaksollisen järjestelmän ryhmien ominaisuuksista puhumalla jalokaasut tai ryhmän 18 alkuaineet joilla on seuraavat ominaisuudet:
- Ne esittävät kaasun tilaa luonnossa.
- Heidän elektroninen kerros tai viimeinen valenssikerros on täydellinen, joten ne eivät ole kovin reaktiivisia.
- Ne ovat luonteeltaan hyvin runsaita. Vedyn jälkeen helium on tunnetuimman maailmankaikkeuden yleisin alkuaine.
- Niillä on alhaiset sulamis- ja kiehumispisteet
- Ne osoittavat negatiivista elektronista affiniteettia
- Jotkut niistä ovat radioaktiivisia, mikä tekee niistä erittäin tärkeitä taloudelliselta kannalta.

Kuva: Slideplayer
Jos haluat lukea lisää artikkeleita, jotka ovat samanlaisia kuin Jaksollisen taulukon ryhmien ominaisuudet, suosittelemme, että kirjoitat luokan Atomi.
Bibliografia
- Quimicas.net (heinäkuu 2015) Kemiallisten alkuaineiden ryhmät. Palautettu https://www.quimicas.net/2015/07/grupos-de-elementos-quimicos.html
- Pacheco, A (s.f) Jaksollisen taulukon ryhmät, niiden kuvaus ja ominaisuudet Palautettu http://www.universidadcultural.com.mx/online/claroline/work/user_work.php? cmd = exDownload & authId = 7750 & assigId = 3 & workId = 131 & cidReset = true & cidReq = CIIS1_002
- Tiedealueen (sf) jaksolliset taulukkoryhmät toipuneet https://www.areaciencias.com/quimica/familias-de-la-tabla-periodica.html