10 kemiallisten alkuaineiden tyyppiä (selitetty ja luokiteltu)
Kuinka monta kemiallista elementtiä maailmankaikkeudessa on oltava? Tällä kysymyksellä on vielä pitkä matka, koska tiedemiehet luovat ajoittain omia keinotekoisia kemiallisia elementtejä.
Voimme kuitenkin vastata kuinka monta kemiallista elementtiä on oltava olemassa, jotain, jonka saamme selville seuraavaksi.
- Aiheeseen liittyvä artikkeli: "11 kemiallista reaktiota"
Kemiallisten alkuaineiden tyypit
Luonnosta löytyy kaikenlaisia aineita. Näitä aineita ei yleensä löydy puhtaana, vaan ne ovat seurausta eri aineiden yhdistämisestä elementtejä tai materiaaleja, jotka ovat erilaisten reaktioiden, prosessien ja ajanjaksojen aikana synnyttäneet kaikenlaisia asia. Maailmankaikkeudessa ei ole mitään, mikä ei olisi seurausta eri tyyppisiin kemiallisiin alkuaineisiin kuuluvien atomien yhdistelmästä, jonka näemme perusteellisesti.
Ennen kuin tarkastelemme kemiallisten alkuaineiden tyyppejä, teemme kuitenkin pienen katsauksen lukion tieteestä ja muistamme, mitä kemialliset elementit ovat.
Kutsumme "kemialliseksi alkuaineeksi" ainetta, joka koostuu samantyyppisestä atomista, eli aineesta, joka on atomisesti puhdas.
Kemiallisia elementtejä ei voida hajottaa yksinkertaisemmiksi, vaan ne luokitellaan jaksollisessa taulukossa alkuaineista maailmankaikkeuden puhtaina materiaaleina.Mutta varo! Emme saa sekoittaa alkuaineita yksinkertaisiin aineisiin, koska tietyissä tapauksissa kaksi tai useampi saman elementin atomi voi muodostua eri tavoin ryhmiteltyjä molekyylejä, jotka aiheuttavat joidenkin kyseisen elementin fysikaalisten ominaisuuksien vaihtelun, esimerkiksi nämä tapaukset isotoopit. Esimerkiksi timantti ja hiili ovat aineita, jotka on valmistettu kemiallisesta elementistä hiili (C). mutta se on järjestetty eri tavoilla ja tuloksena on kaksi täysin erilaista materiaalia.
Carl Sagan Siinä sanottiin, että olemme tähtipölyä, joka heijastaa tähtiä. Tämä kaunis lause ei ole pelkkä vertauskuva, vaan tieteellinen tosiasia. Kemialliset alkuaineet muodostuvat, niin paljon kuin tiedämme, tähtien sisälle monimutkaisten seurauksena fuusio- ja atomifissioprosessit, jotka tuottavat yhä raskaampia elementtejä, tulos prosessista, jota kutsutaan nukleosynteesi.
Suurin osa tunnetuista elementeistä voidaan saada luonnosta, löytyi spontaanisti tai muodosti yhdisteitä muiden alkuaineiden kanssa, kuten uraani (U), hiili (C), pii (Si), hopea (Ag) tai kulta (Au). Toisia taas on valmistettu laboratorioissa, kuten americium (Am), berkelium (Bk) tai curium (Cm). Riippumatta siitä, millä menetelmällä se saadaan tai jos sitä on luonnossa, sen ominaisuuksista riippuen kyseisellä kemiallisella elementillä on joitain tai muita käyttötarkoituksia.
Tällä hetkellä tunnetaan noin 118 kemiallista elementtiä, vaikka kun otetaan huomioon, että ihmiset ovat kyenneet valmistamaan uusia alkuaineita, on ajan kysymys ennen kuin jaksollinen taulukko laajenee.
- Saatat olla kiinnostunut: "Kaksi sähkötyyppiä (selitetty)"
Kemiallisten alkuaineiden päätyypit
Tärkeimmät kemiallisten elementtien tyypit on esitetty jaksollisessa taulukossa luokituksen, jonka perusti venäläinen kemisti Dmitri Mendelejev (1834-1907) 1869. Kemialliset elementit järjestetään visuaalisesti niiden ominaisuuksien ja ominaisuuksien perusteella.
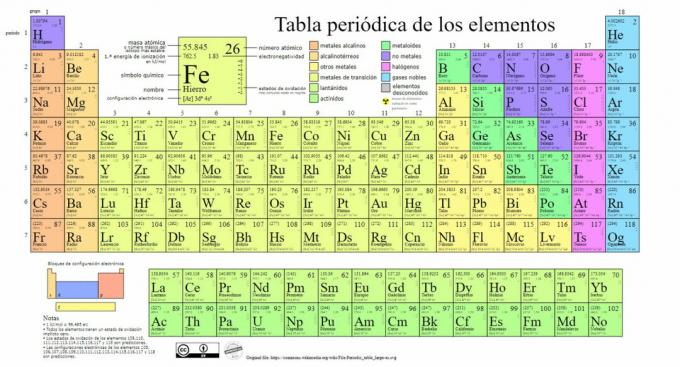
Ajan myötä ja kun kemia teki tärkeitä tieteellisiä löytöjä, tätä taulukkoa laajennettiin peräkkäin, saavuttaen muodon, joka sillä on nykyään 118 tähän mennessä tunnetulla elementillä.
Tällä hetkellä tässä taulukossa on seuraavanlaisia kemiallisia elementtejä:
1. Metallit
Metallit ovat kemialliset elementit, jotka yleensä sisältävät yhdestä kolmeen elektronia atominsa viimeisellä kiertoradalla, elektronit, jotka voidaan helposti siirtää tehdä niistä lämmön ja sähkön johtimia.
Metallit ovat yleensä taipuisia ja taipuisia, ja niillä on tyypillinen kiilto, jonka voimakkuus riippuu atomien muodostavien elektronien liikkeestä. Suurimman osan ajasta metallit ovat kiinteitä huoneenlämmössä elohopeaa lukuun ottamatta.
Metalleista löytyy kultaa (Au), hopeaa (Ag), kuparia (Cu) ja alumiinia (Al), joiden fyysiset ominaisuudet tekevät niistä upeita sähkönjohtimia, vaikka niiden läsnäolo luonnossa on hyvin vaihtelevaa, heijastuu niiden painojen välisessä erossa.
Uskotaan, että 75% luonnossa esiintyvistä kemiallisista elementeistä on metalleja, kun taas loput 25% muodostuvat jalokaasuista, metalloideista ja muista lajeista.
Tässä luokassa on luokituksia, jotka sisältävät aktinideja, lantanideja, siirtymämetalleja, alkalimetalleja, maa -alkalimetalleja ja muita metalleja.
- Aiheeseen liittyvä artikkeli: "10 sinkkiä sisältävää ruokaa"
1.1. Lantanidit
Lantanidielementtejä esiintyy monista mineraaleista koostuvissa kerrostumissa. Ne ovat valkoisia metalleja, jotka hapettuvat helposti joutuessaan kosketuksiin ilman kanssa. Niistä löytyy lantaani (La), promethium (Pm), Europium (Eu) ja Ytterbium (Yb).

- Saatat olla kiinnostunut: "Viisi kemiallisten sidosten tyyppiä: näin aine koostuu"
1.2. Aktinidit
Kaikki aktinidien isotoopit ovat radioaktiivisia. Niistä löytyy aktiniumia (Ac), uraania (U), plutoniumia (Pu) ja einsteiniumia (Es).
1.3. Siirtymämetallit
Siirtymämetallit sijaitsevat jaksollisen järjestelmän keskiosassa. Sen tärkein ominaisuus on se "d" -radan elektroninen kokoonpano on osittain täytetty elektronilla.
Tähän ryhmään kuuluu kaikenlaisia aineita, ja sen laajimman luokituksen mukaan se vastaisi kemiallisia alkuaineita välillä 21-30, 39-48, 71: stä 80: een ja 103: sta 112: een, yhteensä neljäkymmentä, ja niiden joukosta löytyisi vanadiinia (V), ruteniumia (Ru), hopeaa (Ag), tantaalia (Ta) ja Lawrencio (Lr).

1.4. Alkalimetallit
Alkalimetallit ovat kuuden alkuaineen ryhmä, joka koostuu litiumista (Li), natriumista (Na), kaliumista (K), rubidiumista (Rb), cesiumista (Cs) ja franciumista (Fr). Ne ovat kiiltäviä, pehmeitä metalleja, erittäin reaktiivisia normaalissa lämpötilassa ja paineessa ja menettävät helposti ulomman elektroninsa, joka sijaitsee "s" -radallaan.
1.5. Alkalimetallit
Alkalimetallimetallit ovat ryhmä alkuaineita, joista löytyy berylliumia (Be), magnesiumia (Mg), kalsiumia (Ca), strontiumia (Sr), bariumia (Ba) ja radiumia (Ra). Sen nimi tulee sen oksideille annetusta nimestä "maat", joilla on emäksisiä tai emäksisiä ominaisuuksia.
Alkalimetallit ne ovat kovempia kuin emäksiset, loistavat ja ovat hyviä sähköjohtimia. Ne ovat vähemmän reaktiivisia kuin alkaliset ja toimivat hyvinä pelkistävinä aineina. Niillä on kyky muodostaa ionisia yhdisteitä ja niiden kaikkien uloimmassa kuorissa on kaksi elektronia.

1.6. Muut metallit
Luokka "muut metallit" on eräänlaisia aineita, joita löytyy täältä, koska et oikein tiedä mihin laittaa ne.
Ne ovat metallisia elementtejä, jotka sijaitsevat jaksollisessa taulukossa yhdessä metalloidien kanssa p -lohkon sisällä. Ne ovat yleensä pehmeitä ja alhaisilla sulamispisteillä. Niitä ovat mm. Alumiini (Al), indium (In), tina (Sn) ja vismutti (Bi).

2. Ei metalleja
Ei -metalleilla on yleensä viidestä seitsemään elektronia viimeisellä kiertoradallaan että he saavat elektroneja luopumisen sijasta ja siten he onnistuvat saamaan kahdeksan elektronia, jotka vakauttavat ne siten atomit.
Nämä elementit ne ovat erittäin huonoja lämmön- ja sähkönjohtajia. Tämän lisäksi niillä ei ole ominaista kiiltoa, ne eivät ole kovin muokattavia, eivät kovin taipuisia ja ovat erittäin hauraita kiinteässä tilassa. Niitä ei voida rullata tai venyttää, toisin kuin metallit.
Ne ovat enimmäkseen välttämättömiä biologisille järjestelmille, koska ne ovat läsnä orgaaniset yhdisteet, kuten rikki (S), hiili (C), happi (O), vety (H) ja jodi (I).

- Aiheeseen liittyvä artikkeli: "20 jalokivityyppiä (kuvattu ja kuvilla)"
3. Metalloidit
Kuten heidän nimensä viittaa, metalloidit ovat väliluokitus metallien ja ei-metallien välillä, joilla on molempien ryhmien ominaisuudet. Tämä johtuu siitä, että niiden viimeisellä kiertoradalla on neljä atomia, mikä on välitön määrä metalleihin ja ei-metalleihin verrattuna.
Nämä kemialliset elementit johtavat sähköä vain yhteen suuntaan eivätkä salli sen tapahtuvan päinvastaiseen suuntaan kuin metalleissa. Esimerkki tästä on pii (Si), metalloidi, jota käytetään puolijohde -elementtien valmistuksessa elektroniikkateollisuudelle tämän ominaisuuden ansiosta.
Muita metalloideja ovat: boori (B), arseeni (As), antimoni (Sb) ja polonium (Po).

4. Halogeenit
Halogeenit ovat kuuden elementin ryhmä niillä on taipumus muodostaa molekyylejä, jotka koostuvat kahdesta atomista (kaksiatomisista), jotka ovat erittäin kemiallisesti aktiivisia niiden elektronegatiivisuuden vuoksi.
Nämä aineet esiintyvät yleensä ionien muodossa, eli sähköisesti varautuneina molekyyleinä, jotka tässä tapauksessa ovat mononegatiivisia, voimakkaasti hapettavia. Tämä tarkoittaa, että halogeenit ovat syövyttäviä ja syövyttäviä aineita.
Halogeenit ovat: fluori (F), kloori (Cl), bromi (Br), jodi (I), astate (At) ja tenese (Ts).

5. jalokaasut
Jalokaasut ovat seitsemän hengen ryhmä, jonka luonnollinen tila on kaasumainen. Ne esiintyvät tavallisesti piilevien molekyylien muodossa, joilla on erittäin alhainen reaktiivisuus, eli ne eivät reagoi muiden alkuaineiden kanssa, jotka muodostavat muita aineita ja tästä syystä ne tunnetaan inertteinä kaasuina. Tämä johtuu siitä, että sen viimeisellä kiertoradalla on suurin mahdollinen elektronien määrä tällä tasolla, yhteensä kahdeksan.
Tämä valittu elementtiryhmä koostuu heliumista (He), neonista (Ne), argonista (Ar), kryptonista (Kr), ksenonista (Xe), radonista (Rn) ja oganesonista (Og), joka tunnettiin aiemmin nimellä ununoctium.


