Kemiallisten kaavojen tyypit ja ESIMERKIT

Kemiallisia yhdisteitä on kaikissa esineissä ja planeettamme eläviä olentoja. Kun näitä yhdisteitä yritetään tuntea, käytetään yleensä kaavoja, jotka voivat olla enemmän tai vähemmän monimutkaisia ja tarjoavat enemmän tai vähemmän tietoa, ja niitä kutsutaan kemiallisiksi kaavoiksi. Tämän päivän artikkelissa opettaja Puhumme erilaisuudesta kemiallisten kaavojen tyypit ja esimerkkejä niistä. Jos haluat tietää niistä lisää, ilmoitamme sinulle täällä!
The kemialliset kaavat ovat elementtien graafiset ilmaisut jotka muodostavat olemassa olevia kemiallisia yhdisteitä. Nämä kaavat ilmaisevat molekyyliin kuuluvien eri atomien määrän ja osuuden Jotkut kaavatyypit edustavat myös kemiallisen sidoksen tyyppiä, joka yhdistää eri elementtejä. Jokaista tunnetuista molekyyleistä tai yhdisteistä vastaa a kemiallinen nimikkeistö Kansainvälisen puhtaan ja sovelletun kemian liiton (IUPAC) perustama kaavan tyypin mukaan.
Erilaiset kemialliset kaavat, joita on olemassa tarjota tietyntyyppisiä tietoja vaikka yleensä ne kaikki auttavat ymmärtämään sen muodostavien aineiden kemiallista luonnetta ja ilmaisemaan mitä tapahtuu tietyn kemiallisen reaktion aikana, koska joskus jotkut alkuaineet tai yhdisteet voivat muuttua muut. Tästä syystä kemialliset kaavat seuraavat a
edustava alkuaineiden ja molekyylien järjestelmä määräytyy erikoistuneen teknisen kielen mukaan.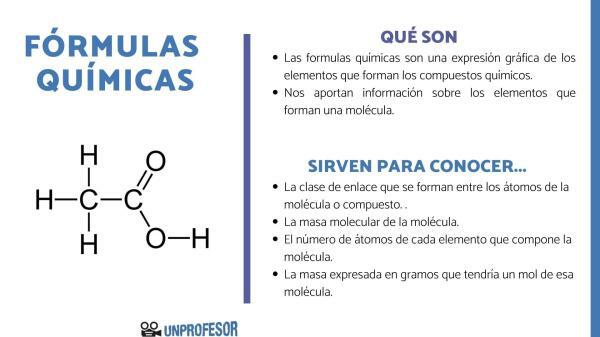
Yleissääntönä on, että kemiallisten kaavojen tyypeistä riippumatta nämä kaavat koostuvat noin kirjaimen muotoiset kemialliset symbolit jotka edustavat eräänlainen atomi joka muodostaa molekyylin mukaan jaksollinen elementtien taulukko ja joitain numeroita alaindeksin muodossa kemiallisen symbolin vieressä, joka edustaa sen suhteellista määrää molekyylissä.
Joillakin kemian aloilla (erityisesti orgaanisessa kemiassa) on joitain kemiallisia ryhmiä, joilla on rakenteellinen ja toiminnallinen toistuminen molekyyleissä, jonka avulla voimme tunnistaa tietyt molekyylin tai yhdisteen fragmentit. Näitä molekyylien fragmentteja kutsutaan kemiallisiksi radikaaleiksi (kun niissä on parittomia elektroneja) tai kemiallisiksi ryhmiksi. toiminnallinen (kun ne ovat atomeja tai yksiköitä, jotka saavat yhdisteen reagoimaan tai käyttäytymään tietyllä tavalla) tavalla).
Jonkin verran esimerkkejä kemiallisista radikaaleista ne ovat metyyliradikaali (CH3), bromiradikaali (Br-) tai klooriradikaali (Cl-). Esimerkkejä funktionaalisista ryhmistä ovat karbonyyliryhmä (CO), hydroksyyliryhmä (OH) tai karboksyyliryhmä (COOH).

Erityyppisissä kemiallisissa kaavoissa käytetään niitä muodostavien alkuaineiden kemiallisia symboleja ja niiden välille muodostuvia loogisia suhteita, jotka ilmaistaan Matemaattiset symbolit. Nimikkeistössä käytetyt erilaiset kemialliset kaavat ovat seuraavat.
Molekyylikaava
Molekyylikaava on yksinkertaisin kaava kuinka monta on olemassa ja ilmaisee atomien tyypin ja kunkin yhdisteessä läsnä olevan atomien lukumäärän. Kaava on hyvin yksinkertainen kirjoittaa ja tulkita, se yksinkertaisesti esittää kemiallisten alkuaineiden symbolit ja niiden numerot alaindeksien muodossa lineaarisen sekvenssin muodossa. Esimerkiksi, meillä on seuraavat kaavat:
- Emäksiset oksidit: Na2O (natriumoksidi), K2O (kaliumoksidi), MgO (magnesiumoksidi).
- Hydroksidit: NaOH (natriumhydroksidi) KOH (kaliumhydroksidi), Ca (OH)2 (kalsiumhydroksidi), Mg (OH)2 (magnesiumhydroksidi)
- Hapot: HCl (suolahappo), H3PO4 (fosforihappo), H2SO3 (rikkihappo), H2SO4 (rikkihappo)
- Suolat: NaCl (natriumkloridi), Na2SO3 (natriumsulfiitti), Na2SO4 (natriumsulfaatti)
puoliksi kehitetty kaava
Puolikehittynyt kaava on samanlainen kuin molekyylikaava ja ilmaisee atomeja, jotka muodostavat yhdisteen, kemialliset sidokset viivojen muodossa ja minkä tyyppisiä sidoksia ovat ne, jotka yhdistävät yhdisteen atomit (yksinkertaiset, kaksois- tai kolmoissidokset). Tämän tyyppisessä kaavassa hiili-vety-sidoksia ei kuitenkaan ole esitetty. Tämän tyyppisiä kaavoja käytetään laajalti orgaanisen kemian nimikkeistössä. Esimerkkejä tämäntyyppisistä kaavoista ovat:
- Orgaanisen kemian puolikehitetyt kaavat: CH3-CH3 (etaani), CH3-CH2-OH (etanoli)
- Puolikehitetyt kaavat epäorgaanisessa kemiassa: ne ovat harvinaisia, jotkut ovat PO(OH)3 (fosforihappo), (OH)2P(O)OP(O)(OH)2 (pyrofosforihappo)
kehitetty kaava
Tämä on toinen kemiallisten kaavojen tyypeistä. Se on hieman monimutkaisempi kuin puoliksi kehitetty. Tämän tyyppisessä kaavassa sidos ja myös atomin sijainti molekyylissä on osoitettu edustaen yhdisteen rakennetta karteesisessa tasossa.
rakennekaava
Tämän tyyppinen kemiallinen kaava on hyvin monimutkainen, mutta se tarjoaa paljon tietoa molekyyleistä, joka edustaa rakenteensa ja organisaationsa lisäksi tilallista muotoaan bi- tai -muodossa kolmiulotteinen.
Lewisin kaava
Ne tunnetaan myös nimellä Lewisin kaavioita tai Lewis-rakenteita ja ne ovat samanlaisia kuin kehitetyt kaavat, mutta myös tässä tapauksessa jokaisessa atomien välisessä sidoksessa jaetut elektronit on esitetty, joita edustavat linkkien linjoihin kiinnitetyt pisteet. Jakamattomat elektronit esitetään myös atomeissa pisteinä. Nämä kaavat ovat erittäin teknisiä ja niitä käytetään hyvin erityisillä aloilla.




