Evolution de la TABLE PERIODIQUE: de sa création à aujourd'hui
Le tableau périodique est l'un des icônes les plus emblématiques de la science. Bien que 2019 ait été le 150e anniversaire de sa création, il ne s'agit en aucun cas d'un document fini. Dans cette leçon d'un ENSEIGNANT, nous verrons ce que évolution du tableau périodique de sa création à nos jours et ce que les progrès de la connaissance des atomes et de leurs propriétés ont rendu possible.
Indice
- Qu'est-ce que le tableau périodique ?
- Premier tableau périodique: l'origine
- Histoire du tableau périodique et évolution
Qu'est-ce que le tableau périodique?
La table périodique Le système périodique d'éléments est le document scientifique qui concentre plus d'informations dans moins d'espace et constitue l'une des icônes les plus puissantes de la science. Il contient une bonne partie du connaissances que nous avons sur la chimie. Il n'existe aucun document similaire dans aucune autre discipline scientifique.
Le tableau périodique des éléments est un
système de classification des éléments chimiques Cela a commencé il y a plus de 200 ans. Ce système de classification a grandi et changé au fil du temps, à mesure que la science progressait et que de nouveaux étaient découverts. éléments chimiques. Cependant, les diverses modifications ont été incorporées en gardant intacte sa structure fondamentale.Le tableau périodique est ainsi nommé parce que exprime graphiquement la façon dont ils répètent à intervalles réguliers certains propriétés chimiques. C'est un type de représentation en deux dimensions ou, dans ses représentations plus modernes, en trois dimensions.
Dans la tableau périodique classique (bidimensionnel) les éléments chimiques sont disposés en groupes ou familles et sont représentés dans le tableau périodique actuel en colonnes verticales. La disposition ordonnée de ces groupes en colonnes donne lieu à une série de lignes, appelées périodes, où les éléments sont classés en fonction de leur poids atomique. Le tableau périodique se compose de sept périodes qui varient en longueur.

Premier tableau périodique: l'origine.
Avant Mendeleev, d'autres scientifiques avaient développé des systèmes de classification des éléments chimiques. Mais, contrairement au tableau périodique des éléments, ils étaient de simples listes d'éléments connus ; tandis que le tableau périodique a la particularité d'être un système de classification en deux dimensions (lignes et colonnes) ou en trois dimensions, dans ses versions les plus modernes, où les éléments chimiques sont disposés en couches.
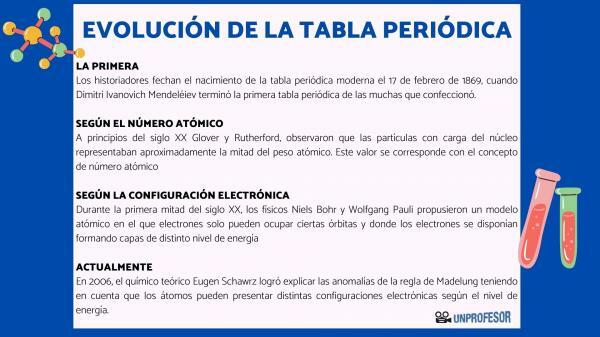
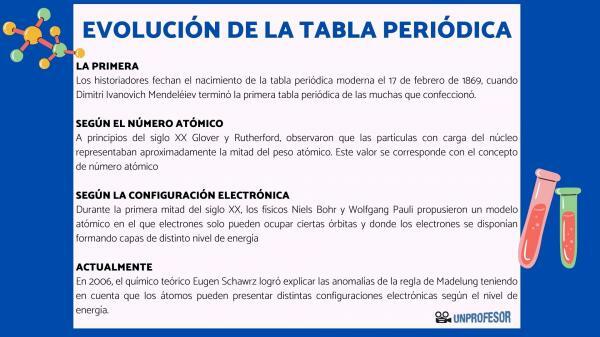
Pour cette raison, les historiens datent la naissance du tableau périodique moderne le 17 février 1869, lorsque Dimitri Ivanovitch Mendeleïev terminer le premier tableau périodique des nombreux qu'il a fait. Ce tableau se composait de 63 éléments disposés en familles et laissait des espaces vides pour les éléments pas encore découvert, mais dont il avait déduit leur poids atomique (comme dans le cas du gallium, du germanium et Scandium)
Les données clés pour la découverte du tableau périodique étaient la connaissance antérieure de la poids atomique de chaque élément.
Qu'est-ce que le poids atomique et le numéro atomique?
Ce nombre représente le poids de l'atome et c'était la seule valeur mesurable de la atomes. Mais il ne s'agissait en aucun cas de mesures directes (il n'y a pas d'appareils de mesure permettant de peser des atomes isolés) mais plutôt d'un système qui établissait une norme dans laquelle une valeur arbitraire de 1 a été donnée à l'atome d'hydrogène et la valeur du poids atomique des éléments restants a été calculée par rapport à cette Schéma.
Les premiers calculs de la numéro atomique des éléments ont été réalisés par le chimiste anglais John Dalton, et a généré un grand débat scientifique au cours de la première moitié du 19ème siècle. Cependant, dans la seconde moitié du 19ème siècle, il y avait déjà un consensus remarquable sur le système de calcul des poids atomiques des éléments. Le poids atomique est devenu à partir de Mendeleïev, un critère clé pour l'ordre correct des éléments dans le tableau périodique.
Lorsque Mendeleev ordonna les éléments connus selon leur poids atomique croissant, ont observé l'apparition de propriétés récurrentes qui permettaient de regrouper les éléments en groupes ou familles d'éléments similaires les uns aux autres. Cependant, dans certains cas, l'ordre des éléments en fonction de leur poids atomique n'a pas répondu aux similitudes entre les éléments qui ont été observées et Mendeleev a changé la position de 17 éléments dans la disposition du tableau périodique malgré leurs poids atomiques, afin de pouvoir les regrouper avec les éléments avec lesquels ils présentaient des analogies.
Ces changements ont montré que certains des poids atomiques acceptés n'étaient pas corrects et ont été recalculés. Malgré les corrections apportées aux poids atomiques, il y avait encore des éléments qui devaient être placés dans des positions autres que celles indiquées par leurs poids atomiques.

Image: BBC.com
Histoire du tableau périodique et évolution.
Malgré la contribution incontestable de Mendeleev, le tableau périodique des éléments n'est pas le résultat du travail d'un seul chercheur. Outre Mendeleïev, pendant la seconde moitié du XIXe siècle et tout au long du XXe siècle, de nombreux Les chimistes ont continué à rechercher la meilleure façon d'organiser les informations sur les éléments chimiques connu. D'autant plus que pendant ce temps la découverte de nouveaux éléments chimiques ou substances simples, grâce à la spectrométrie (qui étudie les interactions entre les atomes et le rayonnement électromagnétique).
La classement des éléments dans le tableau périodique était initialement basée sur les calculs naissants de la poids atomiques des éléments et a révélé des analogies qui ont permis de regrouper les éléments en familles analogues. Même ainsi, la raison de l'apparition de ces propriétés périodiques n'a pas pu être expliquée. C'est tout au long du XXe siècle, avec la découverte de la structure électronique, que l'on a compris la raison de cette périodicité dans les propriétés des éléments.
Le numéro atomique comme critère de tri
Au début du 20e siècle Glover et Rutherford, a observé que les particules chargées du noyau représentaient environ la moitié du poids atomique. Cette valeur correspond à la notion de numéro atomique qui est défini comme le nombre de protons dans le noyau atomique et qui coïncide avec le nombre d'électrons dans un atome neutre. Cette nouvelle valeur justifiait les changements de position de certains éléments qui avaient été effectués jusqu'alors. Par exemple le changement de position entre Tellure et Iode.
En 1913, Henri Mosley a confirmé l'ordre du tableau en fonction du numéro atomique par spectrométrie aux rayons X. L'ordre selon le numéro atomique est toujours en vigueur aujourd'hui.
Parallèlement, au cours du XXe siècle, de nouveaux éléments chimiques continuent d'être découverts grâce à la mécanique quantique et au développement de la technique de bombardement d'atomes par des particules, dès la seconde moitié du siècle. Avec cette nouvelle technique, il a été possible de créer éléments artificiels qui ne sont pas présents dans la nature.
Bien que des progrès aient été réalisés dans la disposition correcte des éléments dans le tableau périodique, encore la raison de l'occurrence récurrente de certaines propriétés (les propriétés périodique). Le développement de la mécanique quantique (branche de la physique qui étudie le comportement de la lumière et des atomes à l'échelle microscopique) à partir de 1920 a été décisive pour expliquer la raison de ces propriétés.
Configuration électronique comme explication des propriétés périodiques
Au cours de la première moitié du 20e siècle, les physiciens Niels Bohr Oui Wolfgang Pauli ils ont proposé un modèle atomique dans lequel les électrons ne peuvent occuper que certaines orbites et où les électrons sont disposés en formant des couches de niveaux d'énergie différents. La façon dont les électrons sont répartis dans les orbitales des différentes couches ou niveaux d'énergie est connue sous le nom de configuration électronique.
La découverte de l'arrangement des électrons dans les configurations électroniques a été fondamentale pour la compréhension de la périodicité des propriétés périodique, car il a été observé que ces propriétés étaient étroitement liées à la configuration électronique la plus externe des atomes (couche de Valence).
L'ordre dans lequel les électrons remplissent les orbitales atomiques a été établi en 1930 par le physicien Erwin Madelung qui a établi une règle numérique pour l'ordre de remplissage. Cette règle est connue sous le nom Règle de Madelung et c'est une règle empirique qui ne pourrait pas être expliquée au moyen de la mécanique quantique.
La séquence de remplissage est simple pour les trois premières lignes du tableau périodique, mais dans le quatrième rangée, où se trouvent les éléments de transition, l'ordre de remplissage subit une série de modifications. Il y a un total de 20 éléments anormaux qui ne suivent pas cette règle.
L'évolution de la table se poursuit aujourd'hui
En 2006, le chimiste théoricien Eugène Schawrz Il a réussi à expliquer les anomalies de la règle de Madelung en tenant compte du fait que les atomes peuvent avoir différentes configurations électroniques selon le niveau d'énergie. En calculant les moyennes, les configurations électroniques de la plupart des éléments sont conformes à la règle de Madelung.
Le tableau périodique continue d'être un sujet de débat au 21e siècle, bien que l'arrangement ou la configuration électronique de éléments, il est toujours valable d'expliquer cet ordre et les anomalies observées dans les configurations électroniques au moyen d'un théorie.
Si vous voulez lire plus d'articles similaires à Evolution du tableau périodique - résumé, nous vous recommandons d'entrer dans notre catégorie de L'atome.
Bibliographie
Divers auteurs. (2019)Spécial: le tableau périodique. Recherche et sciences. Barcelone: Scientific Press S.A.



