Comment obtenir le NUMÉRO DE MASSE?

Les atomes font partie de toute la matière qui compose l'univers. La matière est très variée puisqu'elle est constituée de différents types d'atomes, avec des caractéristiques et des propriétés différentes. Les caractéristiques des différents atomes sont données par les particules qui les forment: protons, électrons et neutrons. Les différentes proportions entre l'une et l'autre sont définies en chimie avec des noms différents (nombre de masse, numéro atomique, etc.). Le nombre de masse nous donne le nombre final ou total de particules dans le noyau, ou ce qui est le même, c'est faire la somme entre les protons et les neutrons, et est utilisé en chimie pour différencier les isotopes d'un élément chimique.
Dans cette leçon d'un ENSEIGNANT, nous verrons le nombre de masse, comment l'obtenir, de quoi s'agit-il exactement et à quoi il sert.
Indice
- Quel est le nombre de masse ?
- Le nombre de masse et les isotopes
- Comment calculer le nombre de masse? - Formule
Quel est le nombre de masse?
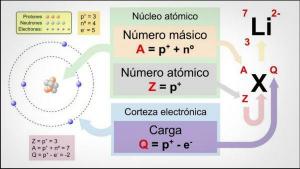
le nombre de masse ce n'est rien de plus que le somme de protons et de neutrons, c'est-à-dire toutes les particules qui sont dans le noyau (rappelez-vous que les électrons tournent autour du noyau, formant la croûte).
Le nombre de masse s'écrit avec le lettre a et il est indiqué en exposant, toujours à gauche du symbole qui indique l'élément dont il s'agit, il est c'est-à-dire que nous le trouverons sous la forme d'un petit nombre placé à gauche du symbole de l'élément, en haut de cette. Il représente la masse de l'atome mesurée en u.m.a (unité de masse atomique) car la masse des électrons est vraiment petite, elle est si petite qu'elle peut être ignorée ou négligée.
Le nombre de masse d'atomes est normalement utilisé pour différencier les isotopes d'un élément chimique.

Image: partage de diapositives
Le nombre de masse et les isotopes.
Isotopes sont des variantes du même élément chimique qui ont différentes quantités de neutrons donc diffèrent par le nombre de masse. Les isotopes peuvent être présents normalement dans la nature (isotopes naturels) ou être entièrement fabriqués par l'homme (isotopes artificiels). Des exemples d'isotopes dans la nature sont ceux du carbone :
Le carbone se présente sous la forme d'un mélange de trois isotopes de numéros de masse 12, 13 et 14: 12C, 13C et 14C.
Les isotopes ont de nombreuses applications: ils sont utilisés pour le traitement du cancer, déterminant l'apparition de poisons dans les tissus comme l'arsenic, marqueurs de réactions chimiques, etc.
Chacun des isotopes d'un élément chimique peut avoir caractéristiques différentes. L'une des caractéristiques les plus connues et les plus utilisées est la demi-vie constante de la demi-vie ou demi-vie. La demi-vie d'un isotope est le temps nécessaire à la moitié des noyaux d'un échantillon initial d'un radio-isotope pour se désintégrer. En pratique, les isotopes ont tendance à se désintégrer, passant de formes moins stables à des formes plus stables. stable, donc cela peut aussi être compris comme le temps qu'il faut pour transmuter ou transformer le moitié de les atomes radioactif à partir d'un échantillon. La demi-vie du carbone 14, qui devient le carbone 12, est très longue et permet de dater d'anciens vestiges organiques comme les fossiles. En revanche, la demi-vie d'autres isotopes tels que l'oxygène-15 n'est que de quelques secondes (122 secondes, pour être exact).
Dans le cas de l'hydrogène, son isotopes naturels ils ont des caractéristiques et des propriétés très différentes, c'est pourquoi ils ont trois noms différents: hydrogène conventionnel ou protium 1H, deutérium 2H (D) et tritium 3H (T). L'hydrogène a d'autres isotopes artificiels (hydrogène-4, hydrogène-5, etc.).

Image: partage de diapositives
Comment calculer le nombre de masse? - Formule.
Afin de calculer le nombre de masse d'un atome ou d'un ion nous devrons ajouter le numéro atomique (nombre de protons dans un atome ou un ion, normalement représenté par "Z") et le nombre d'électrons.
Nombre de masse (A) = numéro atomique (Z) + nombre de neutrons (N)
À = Z + N
Le numéro atomique se trouve dans le tableau périodique des éléments, en haut à gauche de chacun des éléments. De plus, le nombre de masse ou la masse atomique apparaîtra sous l'élément dans le tableau périodique.
Par conséquent, en soustrayant le numéro atomique du nombre de masse, nous pouvons également connaître le nombre de protons.
Nombre de neutrons (N) = nombre de masse (A) - nombre atomique (Z)
N = A - Z
Par exemple, si vous consultez un tableau périodique, vous verrez que le fer a un nombre de masse de 55,84, c'est-à-dire A = 56 arrondi à l'unité la plus proche; Son numéro atomique (Z) est 26, donc son nombre de neutrons sera :
N = A - Z = 56-26 = 30
Si vous voulez lire plus d'articles similaires à Comment obtenir le nombre de masse?, nous vous recommandons d'entrer dans notre catégorie de L'atome.