Protons, neutrons et électrons
Les protons, les neutrons et les électrons sont les particules qui composent l'atome, qui est la plus petite partie de l'élément. Ces particules déterminent les caractéristiques et les propriétés des éléments chimiques.
Les protons et les neutrons sont concentrés dans le noyau atomique, tandis que les électrons sont répartis dans la croûte ou la périphérie de l'atome. Un atome a le même nombre d'électrons et de protons, alors que le nombre de neutrons est variable.
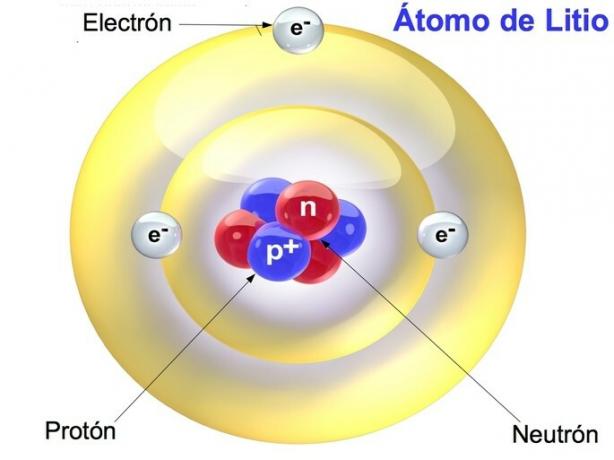
Ensuite, nous présentons un tableau comparatif entre protons, neutrons et électrons.
| Proton | Neutron | Électron | |
|---|---|---|---|
| Définition | Particule subatomique de charge positive | Particule de charge neutre subatomique | Particule subatomique chargée négativement |
| Charge | Positif +1 |
Neutre 0 |
Négatif -1 |
| symbole | p+ | m0 | et- |
| Emplacement dans l'atome | Cœur | Cœur | Orbitales périphériques |
| Masse (kg) | 1673 x 10--27kg | 1 675 x 10--27kg | 9 109 x 10--31kg |
| Masse par rapport au proton (amu) | 1 | 1 | 0,0005 |
| Particule élémentaire | 3 quarks: 2 u et 1 d | 3 quarks: 2 d et 1 u | 1 lepton |
| Découvreur (année) | ET. Rutherford (1911) | J. Chadwick (1931) | J.J. Thomson (1897) |
Qu'est-ce qu'un proton ?
Les protons sont les particules chargées positivement présentes dans le noyau d'un atome. Chaque atome d'un élément a un nombre fixe de protons, qui détermine son numéro atomique, ou Z. Ainsi, l'hydrogène a un proton et Z est égal à 1.
La masse du proton est de 1,673 x 10-27 kg, qui représente 1 unité de masse atomique ou amu (pour son acronyme en anglais unité de masse atomique).
En 1911, Ernest Rutherford découvrit que le noyau d'un atome était minuscule et chargé positivement, d'où le concept de proton.
Le proton est constitué de particules élémentaires appelées quarks ou quarks : 2 quarks u (par en haut= haut) et 1 quartk d (par vers le bas= bas).

Comment calculer les protons d'un atome ?
Le nombre de protons dans un atome peut être déterminé à partir de son numéro atomique, qui est le numéro de position sur le tableau périodique.
Par exemple, l'or Au a un numéro atomique = 79, ce qui signifie que l'or a 79 protons dans son noyau.
Qu'est-ce qu'un neutron ?
Les neutrons sont les particules présentes dans le noyau d'un atome avec les protons. Ils sont désignés par la lettre m et ils sont chargés de manière neutre. Le seul élément qui n'a pas de neutrons est l'hydrogène.
La masse des neutrons est très similaire à celle des protons, donc la somme des masses des protons et des neutrons détermine la masse atomique d'un élément.
Les atomes qui ont le même numéro atomique, mais des nombres différents de neutrons sont appelés isotopes. Par exemple, le deutérium est un isotope de l'hydrogène, qui a un neutron et un proton dans le noyau.
Le physicien anglais James Chadwick a découvert en 1931 cette particule subatomique, avec une masse proche du proton, mais avec une charge électrique neutre, c'est pourquoi on l'appelait un neutron.
Le neutron est composé comme le proton par des quarks: 1 quark u (par en haut= haut) et 2 quartk d (par vers le bas= bas).
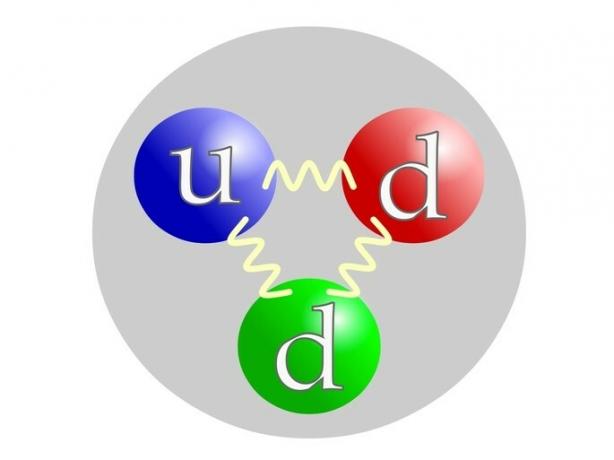
Comment calculer les neutrons d'un atome ?
On peut calculer le nombre de neutrons dans un atome si on connaît sa masse atomique et son numéro atomique Z. Nous savons déjà que le numéro atomique Z est le nombre de protons et que la masse atomique est la somme des protons et des neutrons d'un atome.
Par exemple, l'oxygène a une masse atomique de 16 et Z est 8. Le nombre de protons dans l'oxygène est égal à la masse atomique moins Z :
16 - 8 = 8 neutrons
Qu'est-ce qu'un électron ?
Les électrons sont les particules de l'atome qui se trouvent dans le nuage qui entoure le noyau. Alors que les protons et les neutrons sont concentrés dans le noyau, les électrons sont répartis en couches à l'extérieur.
Les électrons de la couche la plus externe d'un atome peuvent sauter d'un atome à un autre. Cela donne à l'atome une charge électrique différente; par exemple, si un atome gagne un électron, sa charge sera négative, tandis que s'il perd un électron, la charge sera positive.
C'est ce qui se passe dans les ions, c'est-à-dire un atome qui gagne ou perd un ou plusieurs électrons. Par exemple, le chlore a 17 électrons, mais il peut gagner un électron pour devenir un anion chlorure de Cl.-, avec 18 électrons et une charge négative.
L'électron a été découvert en 1897 par J.J. Thomson, la même chose du modèle atomique du "pouding aux raisins".
L'électron est constitué d'une particule élémentaire qui est le lepton.
La masse d'un électron est presque 2000 fois plus petite que celle du proton et du neutron. Supposons qu'un proton ou un neutron ait la taille d'une boule de bowling de 10 livres, alors l'électron aurait la taille d'une petite bille.
Par conséquent, la masse d'électrons dans un atome est négligeable lors du calcul de la masse atomique.
Comment calculer les électrons d'un atome ?
Le nombre d'électrons dans un atome neutre est égal au nombre de protons dans cet atome. Par exemple, l'or Au a 79 protons, il aura donc 79 électrons.
Vous pouvez également être intéressé à voir:
- Cations et anions
- Atomes et molécules.
Les références
Myers, R.L. (2005) Les bases de la physique. Bois vert.
Peake, B.M. (1989) La découverte de l'électron, du proton et du neutron. J. Chemical Education 66: 738. DOI: 10.1021 / ed066p738


