मास नंबर कैसे प्राप्त करें?

परमाणु उन सभी पदार्थों का हिस्सा हैं जो ब्रह्मांड को बनाते हैं। पदार्थ बहुत विविध है क्योंकि यह विभिन्न प्रकार के परमाणुओं से बना है, विभिन्न विशेषताओं और गुणों के साथ। विभिन्न परमाणुओं की विशेषताएं उन्हें बनाने वाले कणों द्वारा दी जाती हैं: प्रोटॉन, इलेक्ट्रॉन और न्यूट्रॉन। एक और दूसरे के बीच के विभिन्न अनुपातों को रसायन विज्ञान में अलग-अलग नामों (द्रव्यमान संख्या, परमाणु संख्या, आदि) के साथ परिभाषित किया गया है। द्रव्यमान संख्या हमें नाभिक में कणों की अंतिम या कुल संख्या बताती है, या जो समान है, वह है प्रोटॉन और न्यूट्रॉन के बीच योग बनाते हैं, और रसायन शास्त्र में एक तत्व के आइसोटोप को अलग करने के लिए प्रयोग किया जाता है रासायनिक।
एक शिक्षक के इस पाठ में हम देखेंगे द्रव्यमान संख्या, इसे कैसे प्राप्त करें, वास्तव में यह क्या है और इसका उपयोग किस लिए किया जाता है.
सूची
- द्रव्यमान संख्या क्या है?
- द्रव्यमान संख्या और समस्थानिक
- द्रव्यमान संख्या की गणना कैसे करें? - सूत्र
द्रव्यमान संख्या क्या है?
जन अंक यह से ज्यादा कुछ नहीं है प्रोटॉन और न्यूट्रॉन का योग
, अर्थात्, सभी कण जो नाभिक में हैं (याद रखें कि इलेक्ट्रॉन नाभिक के चारों ओर परिक्रमा कर रहे हैं, क्रस्ट का निर्माण कर रहे हैं)।द्रव्यमान संख्या को with के साथ लिखा जाता है एक पत्र और यह एक सुपरस्क्रिप्ट स्थिति में इंगित किया जाता है, हमेशा प्रतीक के बाईं ओर जो उस तत्व को इंगित करता है जिसके साथ हम काम कर रहे हैं, यह है अर्थात्, हम इसे एक छोटी संख्या के रूप में पाएंगे जो तत्व प्रतीक के बाईं ओर. के शीर्ष पर स्थित है यह। यह उमा (परमाणु द्रव्यमान इकाई) में मापा गया परमाणु के द्रव्यमान का प्रतिनिधित्व करता है क्योंकि इलेक्ट्रॉनों का द्रव्यमान वास्तव में छोटा होता है, यह इतना छोटा होता है कि इसे अनदेखा या उपेक्षित किया जा सकता है।
परमाणुओं की द्रव्यमान संख्या आम तौर पर इस्तेमाल किया जाता है आइसोटोप को अलग करें एक रासायनिक तत्व का।

छवि: स्लाइडशेयर
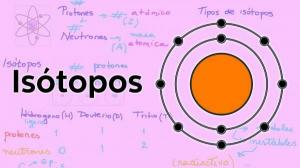
द्रव्यमान संख्या और समस्थानिक।
आइसोटोप एक ही रासायनिक तत्व के रूपांतर होते हैं जिनमें अलग-अलग मात्रा में न्यूट्रॉन होते हैं द्रव्यमान संख्या में भिन्न. समस्थानिक सामान्य रूप से प्रकृति (प्राकृतिक समस्थानिक) में हो सकते हैं या पूरी तरह से मानव निर्मित (कृत्रिम समस्थानिक) हो सकते हैं। प्रकृति में आइसोटोप के उदाहरण कार्बन के हैं:
कार्बन तीन समस्थानिकों के मिश्रण के रूप में द्रव्यमान संख्या 12, 13 और 14 के साथ होता है: 12सी, 13सी और 14सी।
आइसोटोप के कई अनुप्रयोग हैं: उनका उपयोग कैंसर के उपचार के लिए किया जाता है, जो ऊतकों में जहर की उपस्थिति का निर्धारण करता है जैसे कि आर्सेनिक, रासायनिक प्रतिक्रियाओं के मार्कर आदि।
एक रासायनिक तत्व के प्रत्येक समस्थानिक में हो सकता है विभिन्न विशेषताएं. सबसे प्रसिद्ध और उपयोग की जाने वाली विशेषताओं में से एक अर्ध-जीवन का निरंतर आधा जीवन है याlife हाफ लाइफ. एक आइसोटोप का आधा जीवन एक रेडियो आइसोटोप के प्रारंभिक नमूने में आधे नाभिक के विघटन के लिए आवश्यक समय है। व्यवहार में, समस्थानिक विघटित होते हैं, कम स्थिर रूपों से अधिक स्थिर रूपों में बदलते हैं। स्थिर है, इसलिए इसे उस समय के रूप में भी समझा जा सकता है जब इसे ट्रांसमिट करने या बदलने में लगता है का आधा परमाणु एक नमूने से रेडियोधर्मी। कार्बन-14 का आधा जीवन, जो कार्बन-12 बन जाता है, बहुत लंबा होता है और जीवाश्म जैसे प्राचीन कार्बनिक अवशेषों को आज तक इस्तेमाल किया जाता है। इसके विपरीत, ऑक्सीजन -15 जैसे अन्य समस्थानिकों का आधा जीवन केवल सेकंड (122 सेकंड, सटीक होने के लिए) है।
हाइड्रोजन के मामले में, इसका प्राकृतिक समस्थानिक उनके पास बहुत अलग विशेषताएं और गुण हैं, यही वजह है कि उनके तीन अलग-अलग नाम हैं: पारंपरिक हाइड्रोजन या प्रोटियम 1एच, ड्यूटेरियम 2एच (डी) और ट्रिटियम 3एच (टी)। हाइड्रोजन में अन्य है कृत्रिम समस्थानिक (हाइड्रोजन-4, हाइड्रोजन-5, आदि)।

छवि: स्लाइडशेयर
द्रव्यमान संख्या की गणना कैसे करें? - सूत्र।
के लिए परमाणु या आयन की द्रव्यमान संख्या की गणना करें हमें परमाणु संख्या (एक परमाणु या आयन में प्रोटॉन की संख्या, जिसे आमतौर पर "Z" के रूप में दर्शाया जाता है) और इलेक्ट्रॉनों की संख्या को जोड़ना होगा।
द्रव्यमान संख्या (ए) = परमाणु संख्या (जेड) + न्यूट्रॉन की संख्या (एन)
सेवा मेरे = जेड + एन
परमाणु क्रमांक तत्वों की आवर्त सारणी में, प्रत्येक तत्व के ऊपरी बाएँ भाग में पाया जा सकता है। साथ ही, आवर्त सारणी में तत्व के नीचे द्रव्यमान संख्या या परमाणु द्रव्यमान दिखाई देगा।
अतः द्रव्यमान संख्या में से परमाणु क्रमांक घटाकर हम प्रोटॉनों की संख्या भी जान सकते हैं।
न्यूट्रॉनों की संख्या (N) = द्रव्यमान संख्या (A) - परमाणु क्रमांक (Z)
नहीं = ए - ज़ू
उदाहरण के लिए, यदि आप एक आवर्त सारणी देखें, तो आप देखेंगे कि लोहे की द्रव्यमान संख्या 55.84 है, अर्थात, A = 56 निकटतम इकाई के लिए गोल है; इसका परमाणु क्रमांक (Z) 26 है, अतः इसके न्यूट्रॉनों की संख्या होगी:
एन = ए - जेड = 56-26 = 30
अगर आप इसी तरह के और आर्टिकल पढ़ना चाहते हैं मास नंबर कैसे प्राप्त करें?, हम अनुशंसा करते हैं कि आप हमारी श्रेणी दर्ज करें परमाणु.