आवर्त सारणी के समूहों के लक्षण

छवि: प्राकृतिक विज्ञान
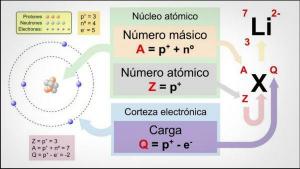
समय समय पर तत्वो की तालिका सभी ऑर्डर करें रासायनिक तत्व अब तक जाना जाता है। हालांकि यह अन्यथा प्रतीत हो सकता है, इन तत्वों को सावधानीपूर्वक नियमों का पालन करते हुए व्यवस्थित किया जाता है: इसके आकार से लेकर इसकी प्रतिक्रियाशीलता तक, अन्य गुणों से गुजरते हुए, जैसे कि अंतिम शेल में इलेक्ट्रॉनों की संख्या परमाणु।
आवर्त सारणी, संक्षेप में, एक तालिका है जो पंक्तियों और स्तंभों से बनी होती है। पंक्तियाँ, जिन्हें रूप में व्यवस्थित किया गया है क्षैतिज, तथाकथित के साथ अवधि सफ़ेद कॉलम, लंबवत, हैं समूहों. लेकिन, यह क्या निर्धारित करता है कि दो तत्व एक ही समूह में हैं या एक अलग समूह में हैं? एक शिक्षक के इस पाठ में हम देखेंगे आवर्त सारणी के समूहों की विशेषताएं.
सूची
- आवर्त सारणी के समूह क्या हैं? आवर्त सारणी में कितने समूह होते हैं?
- समूह 1 (आईए) के लक्षण
- समूह 2 (IIA) विशेषताएँ
- समूह 3 से 12 (बी) के लक्षण
- समूह 13 (IIIA) के लक्षण
- समूह 14 (वैट) की विशेषताएं
- समूह 15 (वीए) के लक्षण
- समूह 16 (वीआईए) के लक्षण
- समूह 17 (VIIA) के लक्षण
- समूह 18 (VIIIA) के लक्षण
आवर्त सारणी के समूह क्या हैं? आवर्त सारणी में कितने समूह होते हैं?
आवर्त सारणी में समूहों की विशेषताओं के बारे में बात करना शुरू करने से पहले, हमें यह जानना होगा कि इस प्रणाली में क्या शामिल है। अब तक खोजे गए रासायनिक तत्वों का अध्ययन करने के लिए, मेंडलीव इस पैटर्न को तालिका में तैयार किया: समय समय पर तत्वो की तालिका. आवर्त सारणी के भीतर क्षैतिज पंक्तियाँ और लंबवत स्तंभ दिखाई देते हैं। आवर्त सारणी के स्तंभों को समूह कहा जाता है, और एक ही समूह के तत्व (उसी में) कॉलम) में समान संयोजकता और समान रासायनिक गुण होते हैं जो हम निम्नलिखित में देखेंगे: खंड।
वर्तमान में आवर्त सारणी है 18 समूहों से बना. प्रत्येक समूह को एक कोड दिया जाता है और, कुछ मामलों में, एक सामान्य नाम।
आवर्त सारणी के 18 समूह वो हैं:
- समूह 1, आईए या क्षार धातु. लिथियम (Li), सोडियम (Na), पोटेशियम (K), रूबिडियम (Rb), सीज़ियम (Cs) और फ़्रांशियम (Fr) से बना है।
- समूह 2, II ए या क्षारीय पृथ्वी धातु. बेरिलियम (बीई), मैग्नीशियम (एमजी), कैल्शियम (सीए), स्ट्रोंटियम (सीनियर), बेरियम (बीए) और रेडियम (आरए) से बना है।
- समूह 3, IIIB या Escandio परिवार। से बना: स्कैंडियम (एससी), येट्रियम (वाई), ल्यूटेटियम (लू), लॉरेंसियो (एलआर), लैंथेनम (ला), एक्टिनियम (एसी)।
- समूह 4, IV बी या टाइटेनियम परिवार। यह तत्वों से बना है: टाइटेनियम (Ti), ज़िरकोनियम (Zr) और हेफ़नियम (Hf) और रदरफोर्डियम (Rf)
- समूह 5, वीबी या वैनेडियम परिवार. यह समूह तत्वों से बना है: वैनेडियम (V), नाइओबियम (Nb), टैंटलम (Ta) और ड्यूबनियम (Db)।
- समूह 6, VIB या क्रोमियम परिवार। समूह 6 में शामिल हैं: क्रोमियम (Cr), मोलिब्डेनम (Mo), वोल्फ्राम या टंगस्टन (W) और सीबोर्गियम (Sg)।
- समूह 7, VIIB या मैंगनीज परिवार। समूह 7 से बना है: मैंगनीज (एमएन), टेक्नेटियम (टीसी), रेनियम (रे) और बोहरियो (बीएच)।
- समूह 8, VIIIB या लौह परिवार। समूह 8 में शामिल हैं: आयरन (Fe), रूथेनियम (Ru), ऑस्मियम (Os) और हैसियम (Hs)।
- समूह 9, IXB या कोबाल्ट परिवार। समूह 9 से बना है: कोबाल्ट (Co), रोडियम (Rh), इरिडियम (Ir) और Meitnerium (माउंट)।
- ग्रुप 10, एक्सबी या निकेल परिवार। यह समूह निम्न से बना है: निकल (Ni), पैलेडियम (Pd), प्लेटिनम (Pt) और Darmstadium (Ds) (पहले Ununnilio (Uun)।
- समूह 11, XIB, तांबा या ढलाई धातुओं का परिवार। इस समूह में शामिल हैं: कॉपर (Cu), सिल्वर (Ag), गोल्ड (Au) और Roentgenium (Rg)।
- समूह 12, XIIB या जिंक परिवार। समूह १२ जिंक (Zn), कैडमियम (Cd), मरकरी (Hg) और कॉपरनिकियम (Cn) से बना है।
- समूह 13, IIIA या बोरॉन परिवार। बोरॉन (B), एल्युमिनियम (Al), गैलियम (Ga), इंडियम (In), थैलियम (Tl) और निहोनियम (Nh) द्वारा निर्मित।
- समूह 14, आईवीए, कार्बन या कार्बोनिड परिवार। समूह 14 तत्वों से बनता है: कार्बन (C), सिलिकॉन (Si), जर्मेनियम (Ge), टिन (Sn), लेड (Pb) और फ्लेरोवियम (Fl)।
- समूह 15, V5, pnicógenos या नाइट्रोजनोइड्स का परिवार। यह नाइट्रोजन (N), फास्फोरस (P), आर्सेनिक (As), सुरमा (Sb), बिस्मथ (Bi) और मस्कोवियो (Mc) से बना है।
- समूह 16, VIA, एम्फ़ोजेन्स, चाकोजेन्स या ऑक्सीजन परिवार। ऑक्सीजन (O), सल्फर (S), सेलेनियम (Se), टेल्यूरियम (Te), पोलोनियम (Po) और लिवरमोरियो (Lv) से बना है।
- समूह 17, VIIA या हैलोजन। यह समूह फ़्लोरीन (F), क्लोरीन (Cl), ब्रोमीन (Br), आयोडीन (I), एस्टेट (At) और टेनीज़ (Ts) से बना है।
- समूह 18, VIIIA या उत्कृष्ट गैसें. समूह द्वारा गठित: हीलियम (He), नियॉन (Ne), आर्गन (Ar), क्रिप्टन (Kr), क्सीनन (Xe), रेडॉन (Rn) और ओगनेसन (Og)।
रासायनिक तत्वों का दूसरा वर्गीकरण
रासायनिक तत्वों के भीतर हम आवर्त सारणी के समूहों का दूसरा वर्गीकरण पा सकते हैं।
- समूह १, २, १३, १४, १५, १६, १७ और १८ मुख्य तत्वों या समूहों के समूह ए से संबंधित हैं
- जबकि समूह 3, 4, 5, 6, 7, 8, 9, 10, 11 और 12 समूह बी या संक्रमण धातुओं से संबंधित हैं।
इनमें से अधिकांश रासायनिक तत्व प्रकृति में पाए जा सकते हैं, या तो शुद्ध या अन्य यौगिकों या तत्वों के मिश्रण में। दूसरी ओर, उनमें से कुछ, जैसे मस्कोवी कृत्रिम तत्व हैं, जो मनुष्य द्वारा प्रयोगशालाओं में बनाए गए हैं और जो प्रकृति में कभी नहीं देखे गए हैं। यहां हम आपको और अधिक विस्तार से खोजते हैं आवर्त सारणी कैसे व्यवस्थित की जाती है.

छवि: आवर्त सारणी
समूह 1 (आईए) के लक्षण.
हम आवर्त सारणी में समूहों की विशेषताओं का विश्लेषण करके शुरू करते हैं, जिसके बारे में बात करते हैं समूह 1 तत्व जिसमें निम्नलिखित हैं विशेषताएं:
- ऑक्सीकरण संख्या +1। इसलिए वे बहुत विद्युत धनात्मक होते हैं और उनमें कम आयनीकरण ऊर्जा होती है क्योंकि वे आसानी से इस इलेक्ट्रॉन को खो देते हैं।
- इलेक्ट्रॉनिक विन्यास ns. है1
- वे रासायनिक रूप से सबसे अधिक प्रतिक्रियाशील रासायनिक तत्व हैं और इसलिए प्रकृति में वे पृथक नहीं हैं बल्कि लवण के रूप में हैं।
- वे कम गलनांक वाली नरम, कम घनत्व वाली धातुएं हैं। इन्हें काटते या पिघलाते समय इनका चांदी का रंग और धात्विक चमक दिखाई देती है।
- वे निंदनीय, तन्य और गर्मी और बिजली के अच्छे संवाहक हैं।
- पानी के साथ प्रतिक्रिया करने पर ये हाइड्रॉक्साइड बनाते हैं

छवि: स्लाइडशेयर
समूह 2 (IIA) विशेषताएँ
समूह 2 तत्व उनके पास निम्नलिखित विशेषताएं हैं:
- ऑक्सीकरण संख्या +2
- इलेक्ट्रॉनिक विन्यास ns. है2
- कम आयनीकरण ऊर्जा, जो समूह में उतरते ही कम और कम हो जाती है। इसीलिए, बेरिलियम को छोड़कर, ये सभी स्पष्ट रूप से आयनिक यौगिक बनाते हैं।
- वे आसानी से हैलोजन के साथ प्रतिक्रिया करके आयनिक लवण बनाते हैं।
- इनका घनत्व कम होता है और ये रंगीन और मुलायम होते हैं

छवि: स्लाइडशेयर
समूह 3 से 12 (बी) के लक्षण.
समूहों के इस समूह को कहा जाता है संक्रमण धातु या ब्लॉक डी चूँकि, यदि हम इसके इलेक्ट्रॉनिक विन्यास को देखें, तो d कक्षक आंशिक रूप से इलेक्ट्रॉनों से भरा होता है।
उनके पास मध्यवर्ती व्यवहार हैं, अर्थात्, बहुत प्रतिक्रियाशील होने के बिना वे बहुत निष्क्रिय नहीं हैं (थोड़ाlit) अभिकारक), उनके पास विशिष्ट ऑक्सीकरण अवस्था या अवस्था, घनत्व या गुण स्पष्ट रूप से नहीं होते हैं परिभाषित।

छवि: स्लाइडप्लेयर
समूह 13 (IIIA) के लक्षण.
समूह १३इसकी विशेषताओं के मामले में भी काफी मध्यवर्ती होने के बावजूद, हम देखते हैं कि यह पिछले वाले की तुलना में कुछ अधिक परिभाषित है। समूह 13 तत्वों में है:
- उनकी ऑक्सीकरण अवस्था +3 है और कुछ तत्वों में +1. भी है
- वे आम तौर पर बहुत अधिक गलनांक वाले उपधातु होते हैं
- उनके पास विशिष्ट गैर-धातु गुण होते हैं

छवि: स्लाइडशेयर
समूह 14 (वैट) की विशेषताएं
कार्बोनिड तत्व वे भी काफी विविध हैं और एक बहुत ही विशेष विशेषता है: जैसे-जैसे हम समूह में नीचे जाते हैं, तत्वों में अधिक धात्विक विशेषताएं होती हैं; कार्बन एक अधातु है, सिलिकॉन और जर्मेनियम अर्धधातु हैं, और, समूह के नीचे, टिन और सीसा धातु हैं।

छवि: स्लाइडसर्व
समूह 15 (वीए) के लक्षण.
आवर्त सारणी के समूहों की विशेषताओं को जारी रखते हुए, अब हम इनके बारे में बात करेंगे समूह 15 तत्व:
- वे उच्च तापमान पर बहुत प्रतिक्रियाशील होते हैं। एक उत्कृष्ट उदाहरण ऑक्सीजन और हाइड्रोजन के साथ नाइट्रोजन की प्रतिक्रिया है, जो केवल उच्च तापमान या दबाव पर होती है।
- उनके पास 5 वैलेंस इलेक्ट्रॉन हैं।
- सहसंयोजक बंधन आमतौर पर एन और पी के बीच बनते हैं, एसबी और बीआई और अन्य तत्वों के बीच आयनिक बंधन।

छवि: स्लाइडप्लेयर
समूह 16 (वीआईए) के लक्षण.
की विशेषताएं समूह 16 तत्व वो हैं:
- उनके पास छह वैलेंस इलेक्ट्रॉन हैं (अंतिम कोश s2पी4)
- जैसे-जैसे इसकी परमाणु संख्या बढ़ती है, इसके गुण अधातु से धात्विक में भिन्न होते हैं।
- जैसे-जैसे हम समूह में नीचे जाते हैं, इसका परमाणु आयतन, घनत्व, आयनों की त्रिज्या और गलनांक और क्वथनांक बढ़ते हैं।
- जैसे-जैसे हम समूह में नीचे जाते हैं, इसकी विशिष्ट ऊष्मा और हाइड्राइड के निर्माण की ऊष्मा कम होती जाती है।

छवि: स्लाइडप्लेयर
समूह 17 (VIIA) के लक्षण.
की विशेषताएं समूह 17 या हलोजन इस प्रकार हैं:
- ये मोनोवैलेंट तत्व होते हैं, यानी इनकी केवल एक संयोजकता संख्या होती है। हैलोजन में संयोजकता -1 होती है।
- वे आमतौर पर धातुओं के साथ मिलकर हैलाइड, हैलाइड या हाइड्रासिड बनाते हैं।
- वे ऑक्सीजन के लिए बहुत कम आत्मीयता रखते हैं, इसलिए वे ऑक्साइड नहीं बनाते हैं, लेकिन बहुत अधिक तापमान पर।

छवि: स्लाइडप्लेयर
समूह 18 (VIIIA) के लक्षण.
और हम इस पाठ को आवर्त सारणी के समूहों की विशेषताओं के बारे में बात करके समाप्त करते हैं महान गैसें या समूह 18. के तत्व जिनमें निम्नलिखित विशेषताएं हैं:
- वे प्रकृति में गैस की स्थिति प्रस्तुत करते हैं।
- उनकी इलेक्ट्रॉनिक परत या अंतिम संयोजकता परत पूर्ण होती है, इसलिए वे बहुत प्रतिक्रियाशील नहीं होती हैं।
- वे प्रकृति में बहुत प्रचुर मात्रा में हैं। हाइड्रोजन के बाद, ज्ञात ब्रह्मांड में हीलियम सबसे प्रचुर मात्रा में तत्व है।
- इनका गलनांक और क्वथनांक कम होता है
- वे नकारात्मक इलेक्ट्रॉनिक आत्मीयता दिखाते हैं
- उनमें से कुछ रेडियोधर्मी हैं, जो उन्हें आर्थिक दृष्टिकोण से बहुत महत्वपूर्ण बनाते हैं।

छवि: स्लाइडप्लेयर
अगर आप इसी तरह के और आर्टिकल पढ़ना चाहते हैं आवर्त सारणी के समूहों की विशेषताएं, हम अनुशंसा करते हैं कि आप हमारी श्रेणी दर्ज करें परमाणु.
ग्रन्थसूची
- Quimicas.net (जुलाई 2015) रासायनिक तत्वों के समूह। से बरामद https://www.quimicas.net/2015/07/grupos-de-elementos-quimicos.html
- पचेको, ए (एस.एफ) आवर्त सारणी के समूह, उनका विवरण और विशेषताएं. से प्राप्त http://www.universidadcultural.com.mx/online/claroline/work/user_work.php? cmd = exDownload और authId = 7750 और assigId = 3 और workId = 131 और cidReset = true और cidReq = CIIS1_002
- विज्ञान क्षेत्र (एस.एफ) आवर्त सारणी समूह Group से प्राप्त https://www.areaciencias.com/quimica/familias-de-la-tabla-periodica.html