पता लगाएँ कि इलेक्ट्रॉन एक ATOM में कहाँ हैं

इलेक्ट्रॉन उप-परमाणु कण होते हैं जो एक इलेक्ट्रॉन बादल में परमाणु नाभिक के चारों ओर घूमते हैं जिसे कहा जाता है इलेक्ट्रॉनिक प्रांतस्था। एक शिक्षक के इस पाठ में हम देखेंगे इलेक्ट्रॉन कहाँ हैं where परमाणु संरचना के भीतर, साथ ही परमाणुओं के विभिन्न राज्यों में इलेक्ट्रॉनों का व्यवहार (जमीनी और कामोत्तेजना की स्थिति), जब परमाणु बनते हैं एकपरमाणुक आयन और जब इलेक्ट्रॉन किसी विशेष परमाणु से बंधे नहीं होते हैं।
सूची
- इलेक्ट्रॉन क्या हैं और ये कहाँ पाए जाते हैं?
- कैसे पता करें कि वैलेंस इलेक्ट्रॉन क्या हैं?
- एक परमाणु के इलेक्ट्रॉन: जमीनी अवस्था और उत्तेजना की अवस्था में
- इलेक्ट्रॉन लाभ या हानि: मोनाटॉमिक आयन गठन
- गति में इलेक्ट्रॉन: विद्युत प्रवाह
इलेक्ट्रॉन क्या हैं और ये कहाँ पाए जाते हैं?
इलेक्ट्रॉनों मैं जनता अंदर खोजें की परमाणुओंजो सबसे छोटी इकाइयाँ हैं जो पदार्थ बनाती हैं। परमाणु अविभाज्य हैं और उनकी संरचना और संरचना सामग्री की विशेषताओं को निर्धारित करती है।
परमाणु तीन प्रकार के होते हैं उप - परमाण्विक कण:
- प्रोटॉन: द्रव्यमान और धनात्मक आवेश वाले कण हैं
- न्यूट्रॉन: द्रव्यमान वाले कण हैं और कोई विद्युत आवेश नहीं है
- इलेक्ट्रॉनों: ये द्रव्यमान रहित और ऋणावेशित कण होते हैं।
प्रोटॉन और न्यूट्रॉन परमाणु के नाभिक का हिस्सा होते हैं, जिससे कि परमाणु नाभिक यह परमाणु के सभी द्रव्यमान और धनात्मक आवेश को केंद्रित करता है।
दूसरी ओर, इलेक्ट्रॉन, नाभिक के चारों ओर परिभाषित कक्षाओं में चक्कर लगाते हैं, जिससे एक इलेक्ट्रॉन बादल बनता है, इलेक्ट्रॉनिक प्रांतस्था. परमाणु का इलेक्ट्रॉनिक खोल सभी ऋणात्मक आवेशों को केंद्रित करता है और इसका कोई द्रव्यमान नहीं होता है।
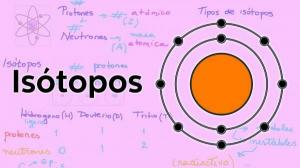
इलेक्ट्रॉनों की कक्षाएँ
परमाणु नाभिक के चारों ओर इलेक्ट्रॉन जिन कक्षाओं का वर्णन करते हैं, वे कुछ पूर्वनिर्धारित कक्षाएँ हैं। अर्थात् परमाणु नाभिक के चारों ओर इलेक्ट्रॉनों के पथ यादृच्छिक नहीं होते हैं। इलेक्ट्रॉनिक शेल के भीतर इलेक्ट्रॉनों के लिए कुछ ही संभावित कक्षाएँ होती हैं; जबकि अन्य परिक्रमाएं प्रतिबंधित हैं। परिभाषित किया जाता है परमाणु कक्षीय नाभिक के आसपास का वह क्षेत्र जिसमें इलेक्ट्रॉन मिलने की प्रायिकता 90% से अधिक हो।
इनमें से प्रत्येक संभावित कक्षा में, इलेक्ट्रॉन जो इसके माध्यम से घूमता है, एक निश्चित ऊर्जा प्राप्त करता है जो कक्षा के नाभिक से आगे बढ़ने पर बढ़ती है। ऑर्बिटल्स को अलग-अलग में बांटा गया है उर्जा स्तर (एन) या परतें, कुल ७ ऊर्जा स्तर होते हैं, जिनमें n = १ सबसे कम ऊर्जा स्तर होता है और एक परमाणु के नाभिक के सबसे निकट होता है। प्रत्येक ऊर्जा स्तर या परत में विभिन्न प्रकार के कक्षक होते हैं (s, p, d और f कक्षक)
वह व्यवस्था जिसमें एक परमाणु में विभिन्न ऊर्जा स्तरों और कक्षकों में इलेक्ट्रॉनों का वितरण होता है, कहलाती है इलेक्ट्रोनिक विन्यास.

छवि: स्लाइडप्लेयर
कैसे पता करें कि वैलेंस इलेक्ट्रॉन क्या हैं?
परमाणुओं की भौतिक और रासायनिक विशेषताओं को उनकी संरचना और विशेष रूप से उनके इलेक्ट्रॉनिक विन्यास द्वारा परिभाषित किया जाता है सबसे बाहरी परत (वैलेंस परत).
रासायनिक तत्व विभिन्न प्रकार के परमाणु होते हैं जो मौजूद होते हैं और उनकी परमाणु संख्या (जेड) और उनकी द्रव्यमान संख्या (ए) द्वारा परिभाषित होते हैं।
- परमाणु संख्या (जेड): एक परमाणु तत्व के प्रोटॉन की संख्या, जो परमाणु के तटस्थ होने पर इलेक्ट्रॉनों की संख्या के बराबर होती है।
- मास संख्या (ए): एक परमाणु तत्व के द्रव्यमान वाले कणों की संख्या, यानी परमाणु नाभिक (प्रोटॉन प्लस न्यूट्रॉन) के कणों का योग।
प्रत्येक तत्व को असाइन किया गया है a रासायनिक प्रतीक जो इसका प्रतिनिधित्व करता है और उन सभी के सेट को वैज्ञानिक दस्तावेज में प्रेषित किया जाता है कि उनके परमाणु क्रमांक के अनुसार आदेश देता है और उन्हें उनकी विशेषताओं के अनुसार परिवारों और affine के समूहों में समूहित करता है: आवर्त सारणी.

एक परमाणु के इलेक्ट्रॉन: जमीनी अवस्था और उत्तेजना की अवस्था में।
में मौलिक अवस्था, जिसे परिभाषित किया गया है न्यूनतम ऊर्जा और अधिकतम स्थिरता की स्थिति एक परमाणु का; इलेक्ट्रॉनों को अलग-अलग परमाणु कक्षाओं में यादृच्छिक रूप से वितरित नहीं किया जाता है, लेकिन अलग-अलग कक्षाओं में एक व्यवस्थित तरीके से कब्जा कर लेते हैं, हमेशा भरते हैं, पहले, निम्न ऊर्जा मुक्त कक्षक.
इस अवस्था में, परमाणु में प्रोटॉन के समान इलेक्ट्रॉनों की संख्या होती है और धनात्मक और ऋणात्मक आवेश एक-दूसरे की क्षतिपूर्ति करते हैं, इसलिए परमाणु समग्र रूप से तटस्थ होता है (इसमें कोई शुद्ध आवेश नहीं होता है)।
हालांकि, इलेक्ट्रॉनों एक कक्षीय से दूसरे कक्ष में कूद सकते हैं ऊर्जा देना या अवशोषित करना। जब किसी परमाणु के इलेक्ट्रॉन ऑर्बिटल्स को व्यवस्थित तरीके से नहीं भरते हैं, तो यह कहा जाता है कि परमाणु. में है उत्साहित राज्य. उत्तेजित अवस्था में, एक या अधिक इलेक्ट्रॉन उच्च ऊर्जा वाले कक्षकों पर कब्जा कर लेते हैं और कम ऊर्जा वाले कक्षकों को खाली छोड़ देते हैं। उत्तेजित अवस्था में परमाणु अत्यधिक अस्थिर होते हैं और जल्दी से जमीनी अवस्था में लौट आते हैं।
कक्षीय बदलते समय इलेक्ट्रॉन ऊर्जा का उत्सर्जन या अवशोषण करता है। यदि इलेक्ट्रॉन निम्न ऊर्जा कक्षा से उच्च ऊर्जा कक्षा में कूदता है, तो परमाणु ऊर्जा को अवशोषित करेगा; जबकि यदि छलांग विपरीत दिशा में (उच्च ऊर्जा वाले कक्षक से निम्न ऊर्जा वाले कक्ष में) की जाती है, तो परमाणु ऊर्जा मुक्त करेगा।

इलेक्ट्रॉनों का नुकसान या लाभ: मोनोआटोमिक आयनों का निर्माण।
इलेक्ट्रॉनिक कॉर्टेक्स (जिसे वैलेंस शेल कहा जाता है) के सबसे बाहरी शेल में इलेक्ट्रॉन ऐसे इलेक्ट्रॉन होते हैं जो वे परमाणु छोड़ सकते हैं या उन्हें शामिल किया जा सकता है इस के लिए। इस तरह एक परमाणु इलेक्ट्रॉन प्राप्त कर सकता है या खो सकता है।
में तटस्थ परमाणु नाभिक में मौजूद प्रोटॉनों की संख्या उसके इलेक्ट्रॉनिक शेल को बनाने वाले इलेक्ट्रॉनों के बराबर होती है। यानी धनात्मक आवेशों की संख्या ऋणात्मक आवेशों की संख्या के बराबर होती है। जब इलेक्ट्रॉनों का लाभ या हानि होता है, तो परमाणु बनते हैं एकपरमाणुक आयन.
एकपरमाणुक आयनों के प्रकार
आयन के आवेश के अनुसार, दो प्रकार प्रतिष्ठित हैं:
- मोनाटॉमिक उद्धरण: परमाणु जो एक या एक से अधिक इलेक्ट्रॉनों को खो चुके हैं, ताकि नाभिक के धनात्मक आवेश के हिस्से की भरपाई न हो। इसलिए परमाणु एक शुद्ध धनात्मक आवेश प्राप्त करता है।
- मोनैटोमिक आयन: परमाणु जिन्होंने एक या एक से अधिक इलेक्ट्रॉन प्राप्त किए हैं ताकि इलेक्ट्रॉनों की संख्या नाभिक में प्रोटॉन की संख्या से अधिक हो ताकि परमाणु एक शुद्ध ऋणात्मक आवेश प्राप्त कर ले।

गति में इलेक्ट्रॉन: विद्युत प्रवाह।
जब इलेक्ट्रॉन वे किसी परमाणु से बंधे नहीं हैं विशेष रूप से वे परमाणुओं के बीच मुक्त स्थान से गुजरते हैं। इलेक्ट्रॉनों का यह स्वतंत्र संचलन विद्युत आवेश का एक प्रवाह बनाता है जो कुछ सामग्रियों (प्रवाहकीय और अर्धचालक सामग्री) के माध्यम से यात्रा कर सकता है।
यह, उदाहरण के लिए, के मामले में क्या होता है विद्युत प्रवाह जो इमारतों, वाहनों आदि को बिजली की आपूर्ति करता है।
अगर आप इसी तरह के और आर्टिकल पढ़ना चाहते हैं इलेक्ट्रॉन कहाँ पाए जाते हैं?, हम अनुशंसा करते हैं कि आप हमारी श्रेणी में प्रवेश करें परमाणु.
ग्रन्थसूची
एलेजांद्रिना गैलेगो पिको, रोजा एम गार्सिनुनो मार्टिनेज, एम जोस मोर्सिलो ओर्टेगा, मिगुएल एंजेल वाज़क्वेज़ सेगुरा। (2018) बेसिक केमिस्ट्री. मैड्रिड: यूनेडो