अम्ल और क्षार के अभिलक्षण: मुख्य अंतर
अम्ल और क्षार की विशेषताएँ वे सभी गुण और गुण हैं जिनसे हम अम्ल और क्षार के बीच अंतर कर सकते हैं।
अर्रेनियस के सिद्धांत के अनुसार, a अम्ल एक पदार्थ है जो प्रोटॉन H. को मुक्त करता है+ जब पानी में घुल जाता है, और a आधार कोई भी पदार्थ है जो हाइड्रॉक्सिल आयनों को छोड़ता है OH- जब जलीय घोल में।
| एसिड | अड्डों | |
|---|---|---|
| आयन निर्माण | वर्तमान | वर्तमान |
| निराकरण प्रतिक्रिया | जब यह आधार के साथ प्रतिक्रिया करता है। | जब यह अम्ल के साथ अभिक्रिया करता है। |
| जल घुलनशीलता | घुलनशील | आंशिक रूप से घुलनशील। कैल्शियम, बेरियम और एल्यूमीनियम हाइड्रॉक्साइड खराब घुलनशील हैं। |
| विद्युत चालकता | वर्तमान | वर्तमान |
| वस्तुस्थिति | ठोस, तरल या गैसीय | ठोस, तरल या गैसीय |
| लिटमस पेपर के साथ प्रतिक्रिया | लाल रंग | नीला रंग |
| पीएच मान | 7. से कम | 7. से बड़ा |
| संयुग्म समकक्ष | एक दुर्बल अम्ल संयुग्मी क्षार बनाता है। | एक कमजोर आधार एक संयुग्मित अम्ल बनाता है। |
| संक्षारक प्रभाव | मजबूत अम्ल | मजबूत आधार |
एसिड के लक्षण
एसिड में कई विशेषताएं होती हैं जिनसे उन्हें पहचाना जा सकता है।
अम्लों से आयन बनाने की क्षमता
अम्लीय पदार्थों की मुख्य विशेषता यह है कि उन्हें आयनित किया जा सकता है, अर्थात इलेक्ट्रॉनों को खोना या प्राप्त करना।
हाइड्रोक्लोरिक एसिड एचसीएल, एक मजबूत एसिड, क्लोराइड आयन सीएल बनाने के लिए आयनित होता है- और प्रोटॉन एच+.
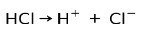
निराकरण प्रतिक्रिया
एक अम्ल क्षार के साथ क्रिया करके लवण और जल बनाता है। इस प्रतिक्रिया के रूप में जाना जाता है निराकरण प्रतिक्रिया. उदाहरण के लिए, HCl NaOH के साथ प्रतिक्रिया करके सोडियम क्लोराइड NaCl (रसोई का नमक) और पानी बनाता है:
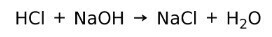
अम्लों की जल विलेयता
अम्ल आमतौर पर पानी में घुलनशील होते हैं। उदाहरण के लिए, हाइड्रोक्लोरिक एसिड या म्यूरिएटिक एसिड पानी में मध्यम रूप से घुलनशील होता है, 82 ग्राम तक एचसीएल को 100 मिलीलीटर पानी में 0ºC पर भंग किया जा सकता है। सल्फ्यूरिक एसिड के मामले में H2दप4पानी के साथ मिश्रण से गर्मी उत्पन्न होती है, इसलिए विस्फोटों से बचने के लिए हमेशा पानी में एसिड मिलाने की सलाह दी जाती है।
अम्ल शक्ति
एसिड कैसे अलग हो जाता है यह निर्धारित करता है कि वे मजबूत हैं या कमजोर। एक एसिड की ताकत इसके द्वारा दी जाती है पृथक्करण निरंतर.
नाइट्रिक अम्ल HNO3 यह है मजबूत अम्ल क्योंकि जलीय घोल में यह पूरी तरह से प्रोटॉन और नाइट्रेट आयनों में आयनित हो जाता है:

इसका मतलब यह है कि जब हम HNO add जोड़ते हैं3 पानी में, पानी का विश्लेषण करने पर हम केवल H. पाएंगे+ और नाइट्रेट आयन, और वस्तुतः कोई HNO. नहीं3.
इसके बजाय, सिरका में पाया जाने वाला एसिटिक एसिड होता है a कमजोर अम्ल, क्योंकि इसका केवल एक हिस्सा अलग किया गया है:
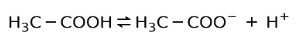
इसलिए इसे दो दिशाओं में तीरों द्वारा दर्शाया गया है, इसका मतलब है कि जलीय घोल में हमारे पास एसिटिक एसिड, एच होगा+ और एसीटेट आयन (H .)3सी-सीओओ-).
अम्लों के पदार्थ की अवस्थाएँ
एसिड तरल, ठोस या गैसीय अवस्था में पाया जा सकता है। उदाहरण के लिए, हाइड्रोक्लोरिक एसिड एचसीएल तरल है, हाइड्रोजन सल्फाइड एचएस एक गैस है, और ऑक्सालिक एसिड एक ठोस है।
अम्ल से लिटमस पत्र के साथ अभिक्रिया

जब हम किसी अम्लीय पदार्थ में लिटमस पत्र की एक पट्टी रखते हैं तो लिटमस पत्र लाल हो जाता है।
अम्लों की उनके pH. द्वारा पहचान
PH H. की मात्रा का माप है+ समाधान में मौजूद है। इस प्रकार, पीएच 0 और 7 के बीच, हम एक एसिड की उपस्थिति में हैं। उदाहरण के लिए, सिरका का पीएच 2 के बराबर होता है, कार की बैटरी में सल्फ्यूरिक एसिड का पीएच 1 के बराबर होता है।
अम्लों की विद्युत चालकता
क्योंकि एसिड विद्युत आवेशित आयनों को अलग कर सकता है और उत्पन्न कर सकता है, अम्लीय समाधान बिजली का संचालन कर सकते हैं। उदाहरण के लिए, कार बैटरी के अंदर, सल्फ्यूरिक एसिड, जो एक मजबूत एसिड है, का उपयोग बिजली के कंडक्टर के रूप में किया जाता है।
मजबूत एसिड का संक्षारक प्रभाव
मजबूत एसिड का संक्षारक प्रभाव होता है, वे कार्बनिक ऊतकों को जला सकते हैं इसलिए उनका संचालन बेहद सावधान रहना चाहिए।
कमजोर एसिड एक संयुग्मित समकक्ष बनाते हैं
कमजोर अम्ल घुलने पर संयुग्म युग्म के रूप में जाना जाता है, अर्थात एक कमजोर अम्ल संयुग्म आधार बनाता है।
उदाहरण के लिए:

इस मामले में, फॉर्मिक या मेथेनोइक एसिड (HCOOH), जब अलग हो जाता है, तो संयुग्मित आधार आयन प्रारूप बनाता है।
इसमें आपकी रुचि हो सकती है:
- मजबूत और कमजोर अम्ल और क्षार base.
- अम्ल और क्षार के उदाहरण.
ठिकानों की विशेषताएं
आगे हम उन क्षारों या क्षारीय विलयनों के गुण प्रस्तुत करते हैं जो उनकी विशेषता रखते हैं।
आधार आयनीकरण क्षमता
बुनियादी या क्षारीय पदार्थ पानी में घुलने पर आयन बनाते हैं:

इस मामले में, सोडियम हाइड्रॉक्साइड NaOH आयनित होकर हाइड्रॉक्साइड आयन बनाता है OH- और एक सोडियम कटियन Na+.
एक क्षार अम्ल के साथ क्रिया करके लवण बनाता है
एक क्षार अम्ल के साथ उदासीनीकरण अभिक्रिया में जल और लवण बनाने के लिए अभिक्रिया करता है, उदाहरण के लिए:

इस मामले में, एल्यूमीनियम हाइड्रॉक्साइड अल (OH)3, एक आधार, एचसीएल के साथ प्रतिक्रिया करता है और एल्यूमीनियम क्लोराइड नमक बनाता है AlCl3 और पानी। पेट द्वारा उत्पादित एसिड को निष्क्रिय करके गैस्ट्रिक भाटा को राहत देने के लिए एल्यूमीनियम हाइड्रॉक्साइड का उपयोग एंटासिड के रूप में किया जाता है।
आधार पानी घुलनशीलता
कुछ क्षार जल में घुलनशील होते हैं। क्षारीय पृथ्वी हाइड्रॉक्साइड, जैसे कैल्शियम हाइड्रॉक्साइड और बेरियम हाइड्रॉक्साइड, पानी में खराब घुलनशील होते हैं। उदाहरण के लिए, सोडियम हाइड्रॉक्साइड या कास्टिक सोडा को 100 मिली पानी में 20 100C पर 109 ग्राम घोला जा सकता है। जबकि मैग्नीशियम हाइड्रॉक्साइड या मिल्क ऑफ मैग्नेशिया Mg (OH)2 यह पानी में व्यावहारिक रूप से अघुलनशील है।
आधार शक्ति
आधार के आयनीकरण की डिग्री के आधार पर, ये मजबूत या कमजोर हो सकते हैं। उदाहरण के लिए, लिथियम हाइड्रॉक्साइड है a मजबूत आधार क्योंकि जलीय घोल में यह पूरी तरह से हाइड्रॉक्साइड आयनों OH और लिथियम ली केशन में आयनित हो जाता है+:
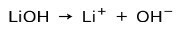
दूसरी ओर, अमोनिया NH3 एक है कमजोर आधार क्योंकि जब यह पानी के संपर्क में आता है, तो सभी अमोनिया अलग नहीं होते हैं:
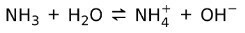
आधारों के पदार्थ की स्थिति
क्षार ठोस, तरल और गैसीय अवस्थाओं में पाए जा सकते हैं। उदाहरण के लिए, शुद्ध सोडियम हाइड्रॉक्साइड ठोस है, अमोनिया एक गैस है।
क्षारकों के लिटमस पत्र के साथ अभिक्रिया
जब हम क्षारीय पदार्थ में लिटमस पेपर की एक पट्टी रखते हैं, तो कागज नीला हो जाता है।
उनके pH. द्वारा क्षारों की पहचान
आधारों को 7 और 14 के बीच पीएच होने की विशेषता है।
 ठिकानों की विद्युत चालकता
ठिकानों की विद्युत चालकता
उनकी आयनन क्षमता के कारण क्षार विद्युत के सुचालक होते हैं। उदाहरण के लिए, क्षारीय बैटरी में, पोटेशियम हाइड्रॉक्साइड KOH का उपयोग विद्युत कंडक्टर के रूप में किया जाता है।
ठिकानों का संक्षारक प्रभाव
मजबूत आधार कार्बनिक ऊतकों को नुकसान पहुंचा सकते हैं। उदाहरण के लिए, रसोई ओवन क्लीनर आम तौर पर मजबूत आधार होते हैं, और उन्हें हमेशा अत्यधिक देखभाल, दस्ताने और आंखों की सुरक्षा के साथ संभालने की सिफारिश की जाती है।
कमजोर आधार संयुग्म प्रतिरूप बनाते हैं
कमजोर क्षार भंग होने पर एक संयुग्मित प्रतिरूप बनाते हैं, अर्थात एक कमजोर आधार एक संयुग्मित अम्ल बनाता है।
उदाहरण के लिए, ट्रिस- (हाइड्रॉक्सीमेथाइल) अमीनो मीथेन (OHCH .)2)3सीएनएच2 एक दुर्बल क्षार है जिसका संयुग्मित अम्ल है (OHCH2)3सीएनएच3+:
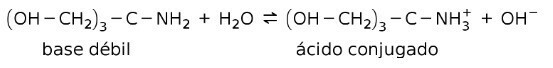
यह बफर पदार्थों की क्रिया का आधार है या बफर, जो पदार्थ हैं जिनका उपयोग समाधान के पीएच को लगातार बनाए रखने के लिए किया जाता है।
आप के बीच अंतर जानने में रुचि हो सकती है:
- अम्ल और क्षार.
- धनायन और ऋणायन



