A savak és bázisok jellemzői: fő különbségek
A savak és bázisok jellemzői mind azok a tulajdonságok és tulajdonságok, amelyekkel megkülönböztethetünk savat és bázist.
Arrehnius elmélete szerint a sav olyan anyag, amely felszabadítja a H protonokat+ vízben oldva, és a bázis bármely olyan anyag, amely hidroxil-ionokat szabadít fel- amikor vizes oldatban van.
| Savak | Alapok | |
|---|---|---|
| Ionképződés | Ajándék | Ajándék |
| Semlegesítési reakció | Amikor egy bázissal reagál. | Amikor savval reagál. |
| Vízben való oldhatóság | Oldódó | Részben oldható. A kalcium-, bárium- és alumínium-hidroxidok rosszul oldódnak. |
| Elektromos vezetőképesség | Ajándék | Ajándék |
| Halmazállapot | Szilárd, folyékony vagy gáznemű | Szilárd, folyékony vagy gáznemű |
| Reagál lakmuszpapírral | Piros színű | Kék színű |
| PH érték | 7 év alatt | Nagyobb, mint 7 |
| Konjugátum megfelelője | A gyenge sav konjugált bázist képez. | A gyenge bázis konjugált savat képez. |
| Maró hatás | Erős savak | Erős alapok |
A savak jellemzői
A savaknak számos olyan tulajdonságuk van, amelyekkel azonosíthatók.
Képesség savakból ionokat képezni
A savas anyagok fő jellemzője, hogy ionizálhatók, vagyis elektronokat veszítenek vagy nyerhetnek.
A sósav, a sósav, erős sav, ionizálódva Cl klóraniont képez- és H proton+.
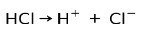
Semlegesítési reakció
Egy sav bázissal reagálva sót és vizet képez. Ez a reakció néven ismert semlegesítési reakció. Például a HCl NaOH-val reagálva nátrium-klorid-NaCl-ot (konyhasó) és vizet képez:
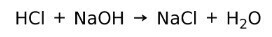
Savak vízoldhatósága
A savak általában vízben oldódnak. Például a sósav vagy muriatinsav mérsékelten oldódik vízben, legfeljebb 82 g HCl oldható 100 ml vízben 0 ° C-on. Kénsav esetén H2SW4, a keverék vízzel hőt termel, ezért a robbanások elkerülése érdekében mindig tanácsos a savat a vízbe adni.
Saverősség
A savak disszociációja meghatározza, hogy erősek vagy gyengék-e. A sav erősségét annak adja disszociációs állandó.
Salétromsav HNO3 ez egy erős sav mert vizes oldatban teljesen protonokká és nitrátionokká ionizálódik:

Ez azt jelenti, hogy amikor hozzáadjuk a HNO-t3 vízben, a víz elemzésekor csak H-t találunk+ és nitrátionok, és gyakorlatilag nincs HNO3.
Ehelyett az ecetben található ecetsav a gyenge sav, mert csak egy része disszociál:
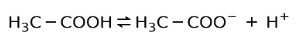
Ezért nyíllal két irányban ábrázolva, ez azt jelenti, hogy vizes oldatban ecetsavat, H-t kapunk+ és az acetát-anion (H3C-COO-).
A savak anyagállapota
A savak megtalálhatók folyékony, szilárd vagy gáz halmazállapotban. Például a sósav-HCl folyékony, a hidrogén-szulfid HS gáz, az oxálsav pedig szilárd.
Reagáljon lakmuszpapírral savakból

Amikor egy lakmuszcsíkot egy savas anyagba helyezünk, a lakmuszpapír pirosra vált.
A savak azonosítása pH-juk alapján
PH a H mennyiségének mértéke+ oldatban van jelen. PH 0 és 7 között tehát sav jelenlétében vagyunk. Például az ecet pH-ja 2, az autóakkumulátorokban a kénsav értéke 1.
Savak elektromos vezetőképessége
Mivel a savak képesek disszociálni és elektromosan töltött ionokat termelni, a savas oldatok vezethetnek áramot. Például az autó akkumulátoraiban a kénsavat, amely erős sav, villamos energia vezetőjeként használják.
Erős savak maró hatása
Az erős savak maró hatásúak, megégethetik a szerves szöveteket, ezért kezelésüknek rendkívül körültekintőnek kell lennie.
A gyenge savak konjugált megfelelőt alkotnak
Gyenge savak oldódva alkotják az úgynevezett konjugátum párokat, vagyis a gyenge savak konjugátum bázist alkotnak.
Például:

Ebben az esetben a hangyasav vagy a metánsav (HCOOH) disszociálódáskor képezi a konjugált bázision formátumot.
Érdekelheti:
- Erős és gyenge savak és bázisok.
- Példák savakra és bázisokra.
Az alapok jellemzői
Ezután bemutatjuk a bázisok vagy lúgos oldatok tulajdonságait, amelyek jellemzik őket.
Bázisionizációs kapacitás
A bázikus vagy lúgos anyagokat vízzel oldott ionok képezik:

Ebben az esetben a nátrium-hidroxid-NaOH ionizálva hidroxid-anion-OH-t képez- és nátrium-kation Na+.
Egy bázis savval reagálva sót képez
Egy bázis semlegesítési reakcióban savval reagálva víz és só képződik, például:

Ebben az esetben az alumínium-hidroxid Al (OH)3bázis, reagál a sósavval és az alumínium-klorid-sót alkotja3 és a víz. Az alumínium-hidroxidot savlekötőként használják a gyomor refluxjának enyhítésére a gyomor által termelt sav semlegesítésével.
Megalapozza a vízoldékonyságot
Néhány bázis vízben oldódik. Az alkáliföldfém-hidroxidok, például a kalcium-hidroxid és a bárium-hidroxid, vízben rosszul oldódnak. Például a nátrium-hidroxidot vagy a nátronlúgot 109 g oldhatjuk 100 ml vízben, 20 ° C-on. Míg a magnézium-hidroxid vagy a magnézium-tej Mg (OH)2 gyakorlatilag vízben nem oldódik.
Alap szilárdság
A bázis ionizációjának mértékétől függően ezek lehetnek erősek vagy gyengék. Például a lítium-hidroxid a erős alap mert vizes oldatban teljesen hidroxid-ionokká és lítium-Li-kationokká ionizálódik+:
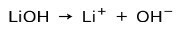
Másrészt ammónia NH3 egy gyenge alap mert amikor vízzel érintkezik, nem minden ammónia disszociál:
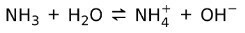
Az alapok állapota
A bázisok megtalálhatók szilárd, folyékony és gáz halmazállapotban. Például a tiszta nátrium-hidroxid szilárd, az ammónia gáz.
Reakció az alapok lakmuszpapírjával
Amikor lúgos anyagba helyezünk egy lakmuszcsíkot, a papír kék színűvé válik.
A bázisok azonosítása pH-juk alapján
A bázisok pH-ja 7 és 14 között van.
 Az alapok elektromos vezetőképessége
Az alapok elektromos vezetőképessége
A bázisok ionizációs képességük miatt jó elektromos vezetők. Például alkáli elemekben a kálium-hidroxid KOH-t használják elektromos vezetőként.
Az alapok maró hatása
Az erős bázisok károsíthatják a szerves szöveteket. Például a konyhai sütőtisztítók általában erős alapok, és mindig ajánlatos rendkívül körültekintően kezelni őket, kesztyűt és szemvédőt viselni.
A gyenge alapok konjugált megfelelőt alkotnak
A gyenge bázisok oldódáskor konjugált megfelelőt alkotnak, vagyis egy gyenge bázis konjugált savat képez.
Például trisz- (hidroxi-metil) -amino-metán (OHCH2)3CNH2 gyenge bázis, amelynek konjugált savja (OHCH2)3CNH3+:
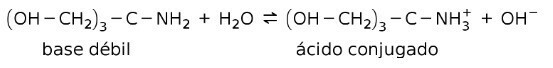
Ez az alapja a pufferanyagok hatásának, ill puffer, amelyek olyan anyagok, amelyeket az oldatok pH-jának folyamatos fenntartására használnak.
Érdekes lehet a következők közötti különbségek ismerete:
- Savak és bázisok.
- Kationok és anionok