Mik azok a KÉMIAI KÉPLETEK, és mire valók [ÖSSZEFOGLALÓ + VIDEÓK]
Bár nem úgy tűnik, a periódusos rendszer kémiai elemei Minden oldalról körülvesznek minket. Sokszor azonban nem külön-külön találhatók meg, hanem különböző kémiai elemek molekuláit vagy makromolekuláit alkotják. A kémiai képletek ezeknek a vegyületeknek a grafikus kifejezései, és nómenklatúrájuk szabványosítására szolgálnak. Ebben a TANÁR leckéjében látni fogjuk mik azok a kémiai képletek és mire valók. Csatlakozzon hozzánk, hogy többet megtudjon!
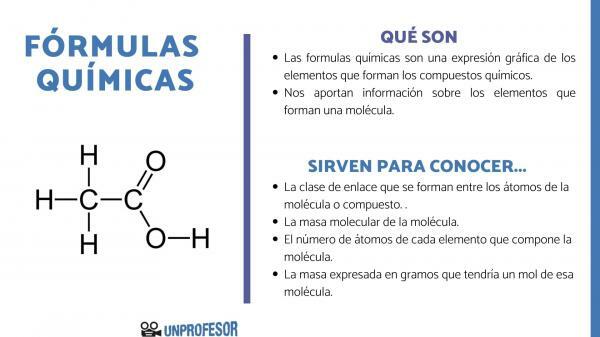
Az kémiai képletek az alkotó elemek grafikus kifejezései kémiai vegyületek.
Ezek a kémiai képletek nem önkényesek, hanem követnek néhányat szigorú szabályok által megállapított kémiai nómenklatúra IUPAC (Tiszta és Alkalmazott Kémia Nemzetközi Uniója).
A kémiai képletek is információt szolgáltatnak számunkra a molekulát alkotó elemekígy például megmondja az azt alkotó egyes atomok számát és arányait, és néha még az atomok típusát is. Kémiai kötés amely ezen elemek között létezik.
Minden létező molekula vagy makromolekula megfelel a kémiai képletének, bárhogy is legyen
különböző típusú képletek. Ezen típusok mindegyike más-más információt ad a molekuláról, de mindegyik segít megérteni a molekulát kémiai természet és segít megértenünk, mi történik a kémiai reakciókban, és hogyan alakulhat át egy vegyület másikká.De ahhoz, hogy megértsük ezt a kémiai nómenklatúrát, bizonyos ismeretekkel kell rendelkezniük a kémiában, mivel ezek egy meglehetősen speciális szaknyelvnek engedelmeskednek.

Kép: Slideplayer
Az kémiai képletek képviselik a kémiai szimbólumok egyesülése, minden egyes atom megfelelő betűjével, ahogy az a periódusos táblázat, és alsó indexek, amelyek azok mennyiségét reprezentáló számok atomok a molekulában
A kémián belül (szerves és szervetlen egyaránt) vannak bizonyos töredékek vagy vegyületek, amelyek szerkezeti és funkcionális bizonyos ismétlődést mutatnak, és nevek alapján azonosítják őket különleges. Ha ezek a fragmensek szabad elektronokkal rendelkeznek, amelyek nem oszlanak meg, akkor gyököknek nevezik őket, és instabil, nagyon reaktív vegyületek, rövid felezési idővel.
Példák a gyökökre metilcsoportok CH3, nitrátcsoportok NO3OH- hidroxilcsoportok vagy a Cl- csoport. Azonban funkcionális csoportoknak nevezzük őket, ha lánchoz kapcsolódó atomok vagy atomcsoportok szén-dioxid (különböző szénnel), és amelyek felelősek a reakciókészségért és a kémiai tulajdonságaiért molekulák.
Ezek a csoportok különösen fontosak a szerves kémiában (az emberi biomolekulák alapvetően szénből és hidrogénből állnak). Néhány példa a funkcionális csoportokra a karbonilcsoport = C = O vagy a karboxilcsoport -COOH.

Kép: Monogramas.com
Ahogy mondtuk, többféle kémiai képlet létezik. Mindegyik képlet más típusú információt ad a molekulákról, és ezért egy adott célt szolgál, anélkül, hogy általánosságban bármely képlet jobb vagy rosszabb lenne egy másiknál.
Az általunk megkülönböztetett kémiai képletek osztályai a következők:
Empirikus képletek
Az empirikus képletek a legegyszerűbb képletek, amelyek egy kémiai molekulát ábrázolnak, néha azt mondják, hogy minimális képletek. Ezek a képletek a molekulában lévő egyes elemek atomjainak arányát reprezentálják, amelyek egész számokra egyszerűsítve mindig a legkisebbek. Példa erre a képletre a CH3 (metilcsoport), amely három hidrogénatomot és egy szénatomot tartalmaz.
Ezek a képletek azonban néha tévhiteket keltehetnek a molekula összetételével kapcsolatban. Ez akkor fordul elő, ha a képlet nem jelzi a tényleges atomok számát a molekulában, mint a peroxid esetében hidrogén, amelynek tapasztalati képlete HO, amikor a képletnek H2O2-nak kell lennie (két hidrogénatom és két atom oxigén). Ez tehát egy nómenklatúra-konvención keresztül történik, mivel mindkét alsó index egyenlő, leegyszerűsödik.
Egyes vegyületek azonban csak empirikus képletekkel ábrázolhatók, mivel ionhálózatokból állnak. Ez előfordul például konyhasóban vagy nátrium-kloridban, amelyet NaCl-ként jelölünk, ami azt jelzi, hogy minden nátriumban van egy klór.
Molekulaképletek
Az ilyen típusú képletek meglehetősen alapvetőek, egyszerűen kifejezik a kovalens molekulában lévő atomok típusát és azok számát. Olyan képletek, amelyek a kémiai elemeket és a számokat lineárisan (alindex formájában) mutatják be. Az ilyen típusú képletre példa az, amikor a glükózt C6H12O6-nak nevezik, ami azt a glükózt fejezi ki. A glükózmolekula hat szénatomból, tizenkét hidrogénatomból és hatból áll oxigén.
A molekuláris képleteket széles körben használják, néha azt mondják, hogy ezek a molekulák valódi képletei. Sok esetben egybeesnek az empirikus képletekkel, például a CO2-ban.
Félig kidolgozott képletek
A félig kidolgozott képletek a molekulaképletekhez hasonló képletek, mivel kifejezik a molekulát alkotó atomokat és azok számát is, de azt is tájékoztatást adnak a kémiai kötésekről (amelyeket az atomok közötti vonalak ábrázolnak) és az azt alkotó szénatomok közötti kötés típusáról (ha egyszerűek, kettős vagy hármas). A félig kidolgozott képlet hasznos a molekulát alkotó gyökök és kémiai szerkezetének azonosítására (a szén- és hidrogénatom közötti kötések nincsenek ábrázolva).
A glükóz esetében félig kidolgozott képlete a CH2OH - CHOH - CHOH - CHOH -CHOH - CHO és mint látható a szén-, hidrogén- ill. az oxigén ugyanaz, mint a molekulaképletben (hat, tizenkettő és hat), és minden egyes kötés (csak a glükóznak vannak kötései egyszerű). Ez a képlet ezért összetettebb, mint a molekuláris képlet.
A félig kidolgozott képleteket néha sűrítettnek nevezik, és talán a képletek legszélesebb körben használt osztálya. használják, különösen a szerves kémiában, bár nem teszik lehetővé a molekulák valós geometriájának megfigyelését.
Kidolgozott képlet
A kidolgozott képletek valamivel bonyolultabbak, mint a félig kidolgozottak. Az ilyen típusú képletekben a kötés és az egyes atomok elhelyezkedése a molekulában derékszögű síkban van ábrázolva, egészen addig, amíg a teljes vegyületet meg nem jelenítjük.
Szerkezeti képlet
A szerkezeti képlet a molekula térbeli szerkezetének grafikus ábrázolása, amely információt ad az atomok térbeli sorrendjéről és eloszlásáról. Ebben a képletben a molekulát alkotó kémiai kötések is megjelennek, és ha egyszeresek, kettősek vagy hármasak. Ez a képlet tehát az, amely a legtöbb információt adja a molekuláról.
Az ilyen típusú képleteket inkább professzionális szinten használják a kémia világában, mivel sokkal tisztábban látják az új molekulák kémiai reakcióit vagy szintézisét.
Lewis-képletek
Ezek összetett, nagyon specifikus és technikai képletek. Lewis-diagramoknak vagy szerkezeteknek is nevezik őket, és hasonlóak a molekulák kidolgozott képleteihez, de Ezenkívül az egyes kémiai kötésekben az atomok megosztó elektronjait jelzik, amelyek az atomok vegyértékétől függően változnak. magában foglal.
Ezekben a képletekben az atomok közötti kötéseket vonalak (azt is jelzik, hogy egyesek, kettősek vagy hármasak) vagy pontpárral ábrázolják. A magányos elektronokat vagy az elektronokat, amelyek nem osztoznak a kötésben, a megfelelő atom körüli pontok képviselik.

Kép: Szerves kémia
A képletek írásakor néha hivatkoznak aoxidációs szám az elem (ionos vegyületekben gyakori). Ezek pozitív és negatív számok halmaza minden elemhez társítva.
- Az oxidációs számok úgy értelmezhetők, mint a elektronok száma hogy egy elem kovalens kötésben osztozik vagy ionos kötésben átadódik.
- Amikor az atom feletti oxidációs jel az negatív, azt jelenti, hogy ez az elem befogja az elektronokat, és a mellette lévő szám a befogott elektronok száma. Ezért a -1 oxidációs állapot azt jelenti, hogy az elem egy elektront vesz fel, -2, amely kettőt, és így tovább.
- Amikor az oxidáció jele az pozitív, az atom felad egy elektront, és az ezt a jelet kísérő szám a leadott elektronok száma. Hasonlóképpen, a +1 oxidációs állapot azt jelenti, hogy egy elektront ad, a +2 azt, hogy kettőt, és így tovább.
Ez leginkább azért működik ionos vegyületek, kovalens kötésekben, bár az értelmezés hasonló, nem ugyanaz, mivel ezek a kötések osztoznak az elektronokon. Ezekben a vegyületekben több elektronegatív elemről beszélünk, amelyek többet húznak az elektronpárból és negatívabb töltés marad, attól függően, hogy hány elektront vonz. Ez látható a Lewis-képletek.
Ha tudni akarja, hogy mire valók a kémiai képletek, akkor figyelembe kell vennie, hogy ez a szám lehetővé teszi számunkra, hogy néhányat megkapjunk molekula információ, mint ők:
- Az link osztály amelyek a molekula vagy vegyület atomjai között képződnek. Ezek a kötések általában kovalensek, ha nem fémes és ionos atomok vesznek részt benne, ha fémes és nem fémes kötésekről van szó.
- Az molekulatömeg a molekulának.
- Az atomok száma a molekulát alkotó minden egyes elemről. Néha a molekula százas összetételének is nevezik.
- A tömeg ben kifejezve gramm amelynek egy mólja lenne abból a molekulából.
Egy ionos vegyület, például nátrium-klorid vagy konyhasó esetében ez nem feltétlenül helyes beszélni a molekulákról (bár néha megtörténik), hogy ezek általában nagy aggregátumokat képeznek és makrómolekulák. Ebben az esetben a vegyület képlete segít abban, hogy megnézzük, mely ionok és milyen mennyiségben alkotják azt.