Untuk apa TABEL PERIODIK itu?
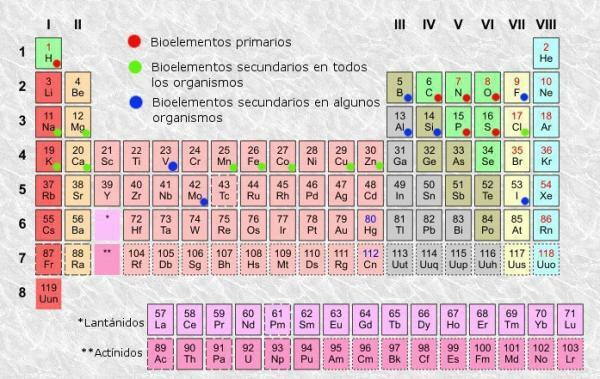
Tabel periodik adalah sistem klasifikasi untuk unsur-unsur atom yang ditemukan pada tahun 1869 oleh ahli kimia Rusia Dmitri Mendeleev dan kemudian direorganisasi dan diperbarui oleh ahli kimia lain hingga mencapai penampilannya arus. Meskipun merupakan alat yang telah terbukti berguna sepanjang sejarah (itulah sebabnya alat ini terus digunakan dan diperbarui), ini adalah sangat membosankan untuk dipelajari dan dipahami, itulah sebabnya kita semua bertanya pada diri sendiri pertanyaan "Untuk apa meja itu? berkala?”.
Jika kamu ingin tahu untuk apa tabel periodik? dan mengapa penting untuk memahami sifat-sifatnya, teruslah membaca pelajaran ini dari seorang GURU.
Indeks
- Klasifikasi tabel periodik
- Menemukan nama atau simbol suatu unsur dengan tabel periodik periodic
- Mengetahui massa atom suatu unsur
- Mengetahui nomor atom suatu unsur
- Memprediksi jari-jari atom suatu unsur
- Bandingkan energi ionisasi dua unsur
- Menemukan keelektronegatifan suatu unsur kimia
- Bandingkan afinitas elektron dua unsur
Klasifikasi tabel periodik.
Seperti dalam tabel apa pun, dalam tabel periodik Dari unsur-unsur tersebut kita dapat membedakan kolom (vertikal) dan baris (horizontal). Dalam tabel periodik terdapat 18 kolom atau golongan dan 7 baris atau periode.
Selain itu, Anda akan dapat memverifikasi bahwa biasanya di dalam setiap kotak dalam tabel, setidaknya muncul informasi berikut:
- Simbol unsur kimia: singkatan atau tanda yang digunakan untuk mengidentifikasi unsur-unsur. Mereka biasanya terdiri dari satu atau dua huruf, yang pertama selalu dikapitalisasi.
- Nama Unsur Kimia: nama unsur kimia yang sesuai dengan singkatan atas. Biasanya di bawah simbol.
- Nomor atom: jumlah proton yang dimiliki setiap atom unsur tersebut. Biasanya muncul di kiri atas kotak item (atau di kanan atas tabel yang lebih lengkap).
- Massa atom: massa atom biasanya dapat dianggap sebagai massa total proton dan neutron dalam satu atom. Ini diatur di bawah nama elemen dalam tabel paling sederhana, meskipun di tabel lain mungkin muncul di bagian kanan atas kotak elemen.
Ada tabel periodik yang mencakup informasi lain yang lebih kompleks dan spesifik seperti: keadaan oksidasi (berguna ketika merumuskan senyawa kimia, misalnya), energi ionisasi, elektronegativitas, dll., tetapi tabel periodik dasar biasanya memberikan informasi yang cukup dan biasanya cukup untuk pengguna rata-rata, yang darinya dapat mengetahui informasi seperti yang kami ceritakan di bawah ini.

Cari tahu nama atau lambang suatu unsur dengan tabel periodik.
Terkadang kita tahu simbol unsur kimia tapi kami tidak tahu namanya. Di lain waktu, kita tahu nama unsur kimia, tetapi bukan singkatan atau simbolnya. Sebenarnya, sangat mudah hal ini terjadi pada Anda di kelas.
Dalam kasus ini, kita dapat menggunakan tabel periodik, tanpa perlu tabel yang rumit, dan berkonsultasi dengan data yang hilang dengan cepat dan akurat.
Mengetahui massa atom suatu unsur.
Terkadang kita mengetahui unsur kimia yang kita hadapi tetapi kita perlu mengetahuinya massa atom, yaitu, berapa berat atom dari unsur tersebut.
Informasi ini akan berguna, misalnya, saat melakukan tugas-tugas berikut:
- Menghitung jumlah spesifik suatu zat.
- Menganalisis hasil yang diperoleh dalam tes atau percobaan.
- Hitung persentase massanya.
- Memahami massa molar yang tepat dari molekul kompleks.
Mengetahui nomor atom suatu unsur.
Nomor atomnya adalah jumlah proton yang dimiliki atom suatu unsur. Dalam atom netral, selain kation (bermuatan positif, dengan satu elektron kurang dari keadaan normalnya) atau anion (bermuatan negatif, dengan satu elektron lebih banyak dari keadaan normalnya), jumlah proton sama dengan jumlah elektron.
Jumlah proton adalah faktor penentu dalam membedakan satu unsur dengan unsur lainnya, karena jumlah elektron atau neutron tidak mengubah jenis unsur.

Memprediksi jari-jari atom suatu unsur.
Jari-jari atom adalah setengah jarak antara pusat dua atom dari unsur yang sama yang hampir tidak saling bersentuhan. Dalam hal ini, ketahuilah posisi unsur kimia pada tabel periodik Ini dapat membantu kita untuk mengetahui perkiraan jari-jari atomnya atau dibandingkan dengan elemen lain. Untuk ini, kita harus tahu bahwa jari-jari atom:
- Ini meningkat saat kita bergerak dari atas ke bawah tabel periodik.
- Itu turun saat kita bergerak dari kiri ke kanan melalui tabel periodik.
Dengan cara ini, kalsium lebih kecil dari rubidium tetapi lebih besar dari besi.
Belajar lebih tentang Berapa jari-jari atom atomic dengan video pelajaran lainnya dari seorang GURU.
Bandingkan energi ionisasi dua unsur.
Itu energi ionisasi adalah energi yang diperlukan untuk melepaskan elektron dari atom suatu unsur. Dalam hal ini, jika kita mengetahui posisi dua unsur dalam tabel periodik, kita dapat mengetahui dari unsur mana akan lebih mudah untuk "mengambil" elektron. Kami hanya perlu mempertimbangkan bahwa:
- Energi ionisasi berkurang saat bergerak ke atas dan ke bawah tabel periodik.
- Energi ionisasi meningkat saat Anda bergerak dari kiri ke kanan tabel periodik.
Antara berilium dan oksigen, oksigen memiliki lebih banyak energi ionisasi. Jika kita membandingkan oksigen dan belerang, yang berada dalam golongan yang sama tetapi pada periode berikutnya, oksigen juga memiliki energi ionisasi yang lebih tinggi karena lebih tinggi pada tabel periodik.
Mengetahui keelektronegatifan suatu unsur kimia.
Keelektronegatifan adalah kemampuan atom untuk menarik elektron. Dalam praktiknya ini diterjemahkan menjadi kemampuan untuk membentuk ikatan kimia. Untuk mengetahui apakah suatu unsur kimia akan mempunyai kapasitas yang besar untuk membentuk ikatan kimia atau tidak, kita hanya perlu memperhatikan pola berikut dalam tabel periodik, yaitu:
- Itu turun saat bergerak naik dan turun.
- Ini meningkat saat Anda bergerak dari kiri ke kanan.
Seperti pada kasus sebelumnya, oksigen lebih elektronegatif daripada berilium dan belerang karena letaknya lebih ke kanan daripada yang pertama dan lebih tinggi dari belerang.

Bandingkan afinitas elektron dua unsur.
Itu Afinitas elektronik Apakah dia perubahan energi yang dialami atom netral ketika menarik elektron menjadi ion negatif. Dalam hal ini, afinitas elektronik tidak bervariasi persis seperti dalam kasus sebelumnya, meskipun kita dapat mengatakan bahwa, secara umum, afinitas elektronik:
- Itu naik, pada periode yang sama, dari kiri ke kanan.
- Naik, di grup yang sama, dari bawah ke atas.
Jika Anda ingin membaca lebih banyak artikel serupa dengan Untuk apa tabel periodik?, kami sarankan Anda memasukkan kategori kami atom.
Referensi
Apakah Anda memiliki masukan atau komentar tentang penggunaan tabel periodik? Jangan ragu untuk meninggalkannya di bagian komentar kami! Apakah Anda menyukai artikel ini? Anda juga dapat meninggalkan peringkat Anda di bawah ini!



