Cari tahu di mana elektron berada dalam ATOM

Elektron adalah partikel subatom yang berputar mengelilingi inti atom dalam awan elektron yang disebut korteks elektronik. Dalam pelajaran ini dari seorang GURU kita akan melihat dimana elektron dalam struktur atom, serta perilaku elektron di berbagai keadaan atom (keadaan dasar dan gairah), ketika atom terbentuk ion monoatomik dan ketika elektron tidak terikat pada atom tertentu.
Indeks
- Apa itu elektron dan di mana mereka ditemukan?
- Bagaimana cara mengetahui elektron valensi?
- Elektron atom: keadaan dasar dan dalam keadaan eksitasi
- Keuntungan atau Kerugian Elektron: Formasi Ion Monatomik
- Elektron bergerak: arus listrik
Apa itu elektron dan di mana mereka ditemukan?
Itu elektron aku tahu temukan di dalam dari atomyang merupakan unit terkecil yang menyusun materi. Atom tidak dapat dibagi dan struktur serta komposisinya menentukan karakteristik bahan.
Atom terdiri dari tiga jenis: partikel sub atom:
- Proton: adalah partikel bermassa dan bermuatan positif
- Neutron: adalah partikel bermassa dan tidak bermuatan listrik
- elektron: Mereka adalah partikel tak bermassa dan bermuatan negatif.
Proton dan neutron merupakan bagian dari inti atom, sehingga inti atom itu memusatkan semua massa dan muatan positif atom.
Elektron, di sisi lain, berputar di sekitar nukleus dalam orbit yang ditentukan, membentuk awan elektron yang disebut korteks elektronik. Kulit elektron atom memusatkan semua muatan negatif dan tidak memiliki massa.
Orbit elektron
Orbit yang digambarkan elektron di sekitar inti atom adalah orbit tertentu yang telah ditentukan sebelumnya. Artinya, jalur elektron di sekitar inti atom tidak acak. Di dalam kulit elektron hanya ada beberapa kemungkinan orbit untuk elektron; sementara orbit lainnya dilarang. didefinisikan sebagai orbital atom daerah di sekitar nukleus di mana kemungkinan menemukan elektron lebih besar dari 90%.
Di setiap orbital yang mungkin ini, elektron yang bersirkulasi melaluinya memperoleh energi tertentu yang meningkat karena orbital lebih jauh dari nukleus. Orbital dikelompokkan menjadi berbeda tingkat energi (n) atau lapisan, ada total 7 tingkat energi, dengan n = 1 adalah tingkat energi terendah dan yang paling dekat dengan inti atom. Pada setiap tingkat atau lapisan energi terdapat berbagai jenis orbital (orbital s, p, d dan f)
Susunan di mana elektron didistribusikan dalam tingkat energi dan orbital yang berbeda dalam atom dikenal sebagai konfigurasi elektronik.

Gambar: Pemutar slide
Bagaimana cara mengetahui elektron valensi?
Karakteristik fisik dan kimia atom ditentukan oleh komposisinya dan, terutama, oleh konfigurasi elektronnya lapisan terluar (lapisan valensi).
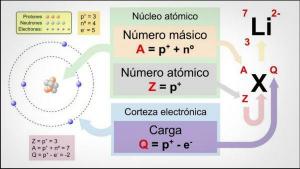
Unsur kimia adalah berbagai jenis atom yang ada dan ditentukan oleh nomor atomnya (Z) dan nomor massanya (A).
- Nomor atom (Z): jumlah proton suatu unsur atom, yang sama dengan jumlah elektron jika atom tersebut netral.
- Nomor massa (A): jumlah partikel dengan massa unsur atom, yaitu jumlah partikel inti atom (proton ditambah neutron).
Setiap elemen diberi simbol kimia yang mewakilinya dan himpunan dari semuanya itu dimasukkan ke dalam dokumen ilmiah yang mengurutkan menurut nomor atomnya dan mengelompokkannya menurut sifat-sifatnya ke dalam famili dan kelompok affine: the Tabel periodik.

Elektron atom: keadaan dasar dan dalam keadaan eksitasi.
Dalam keadaan dasar, yang didefinisikan sebagai keadaan energi minimum dan stabilitas maksimum sebuah atom; elektron tidak didistribusikan secara acak dalam orbital atom yang berbeda, tetapi menempati orbital yang berbeda secara teratur, selalu mengisi di tempat pertama, orbital bebas energi yang lebih rendah.
Dalam keadaan ini, atom memiliki jumlah elektron yang sama dengan proton dan muatan positif dan negatif saling mengimbangi, oleh karena itu atom secara keseluruhan netral (tidak memiliki muatan bersih).
Namun, elektron dapat melompat dari satu orbital ke orbital lainnya melepaskan atau menyerap energi. Bila elektron-elektron suatu atom tidak mengisi orbital-orbitalnya secara teratur, dikatakan bahwa atom tersebut berada dalam keadaan tereksitasi. Dalam keadaan tereksitasi, satu atau lebih elektron menempati orbital energi yang lebih tinggi meninggalkan yang kosong dengan energi yang lebih rendah. Dalam keadaan tereksitasi atom sangat tidak stabil dan cenderung cepat kembali ke keadaan dasar.
Saat mengubah orbital elektron memancarkan atau menyerap energi. Jika elektron melompat dari orbit energi yang lebih rendah ke energi yang lebih tinggi, atom akan menyerap energi; sedangkan jika lompatan dilakukan dengan arah yang berlawanan (dari orbital berenergi tinggi ke orbital berenergi lebih rendah), atom akan melepaskan energi.

Kehilangan atau perolehan elektron: pembentukan ion monoatomik.
Elektron di kulit terluar dari korteks elektronik (disebut kulit valensi) adalah elektron yang mereka dapat meninggalkan atom atau mereka dapat digabungkan untuk yang satu ini. Dengan cara ini atom dapat memperoleh atau kehilangan elektron.
Di sebuah atom netral jumlah proton yang ada dalam nukleus sama dengan jumlah elektron yang menyusun kulit elektronnya. Artinya, jumlah muatan positif sama dengan jumlah muatan negatif. Ketika ada keuntungan atau kehilangan elektron, atom membentuk ion monoatomik.
Jenis ion monoatomik
Menurut muatan ion, dua jenis dibedakan:
- Kation monoatomik: atom yang kehilangan satu atau lebih elektron, sehingga sebagian muatan positif inti tidak terkompensasi. Oleh karena itu atom memperoleh muatan positif bersih.
- Anion monoatomik: atom yang telah memperoleh satu atau lebih elektron sehingga jumlah elektron lebih besar dari jumlah proton dalam inti sehingga atom memperoleh muatan negatif bersih.

Elektron bergerak: arus listrik.
Ketika elektron mereka tidak terikat pada atom apa pun khususnya mereka bergerak melalui ruang bebas antara atom. Pergerakan elektron yang independen ini membentuk aliran muatan listrik yang dapat merambat melalui bahan tertentu (bahan konduktif dan semikonduktor).
Ini misalnya adalah apa yang terjadi dalam kasus arus listrik yang memasok listrik ke gedung, kendaraan, dll.
Jika Anda ingin membaca lebih banyak artikel serupa dengan Di mana elektron ditemukan?, kami sarankan Anda memasukkan kategori kami atom.
Bibliografi
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel ngel Vázquez Segura. (2018) kimia dasar. Madrid: Uned