Parti di un atomo e loro caratteristiche
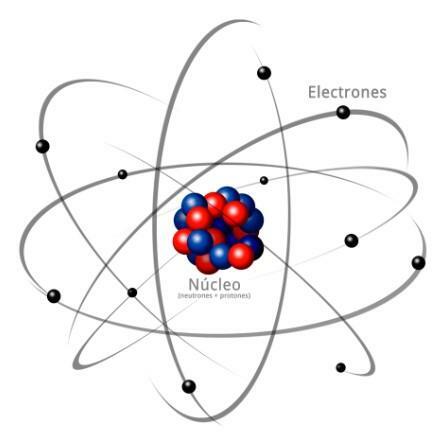
Immagine: Answers.tips
Gli atomi sono gli elementi di base che materia di forma, essendo presente in tutti gli stati della materia. Sono elementi molto piccoli, impossibili da vedere attraverso l'occhio umano ma sono davvero importanti per il nostro universo. Per capire meglio come sono e come funzionano gli atomi, in questa lezione di un INSEGNANTE di cui parleremo parti di un atomo e loro caratteristiche.
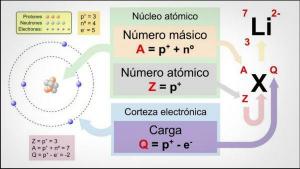
Tutti gli atomi sono costituiti da a nucleo e una crosta. Il nucleo, come indica il nome, è la parte centrale dell'atomo, dove le particelle la cui carica è positiva e che sono chiamate protoni, e le particelle la cui carica è neutra, cioè non hanno carica elettrica, ricevendo il nome di neutroni. La massa di entrambe le particelle, sia protoni che neutroni, è simile. Tutti gli atomi dello stesso elemento chimico hanno un uguale numero di protoni, questa cifra è chiamata numero atomico e la lettera Z è usata per rappresentarla.
D'altra parte c'è il Corteccia quale è parte esterna dell'atomo
. Nella corteccia troviamo il elettroni, che sono particelle cariche negativamente. Gli elettroni ruotano a grande velocità attorno al nucleo a diversi livelli, essendo particelle molto più piccole di quelle che si trovano nel nucleo.Essendo neutroni neutri, protoni positivi ed elettroni negativi, l'atomo ha una carica elettrica neutra, poiché hanno lo stesso numero di protoni degli elettroni. Sebbene ci siano casi in cui gli elettroni sono in numero minore o maggiore dei protoni, causando la carica l'atomo è negativo o positivo, in questo caso riceve il nome di ione, anione se è negativo o catione se è positivo.
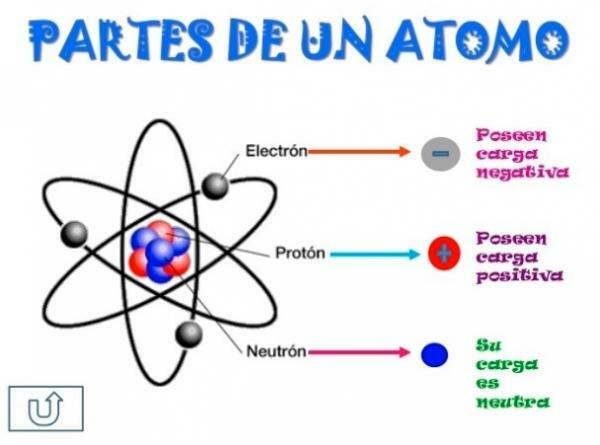
Immagine: Brainly
Per continuare con questa lezione sulle parti di un atomo e le loro caratteristiche, dobbiamo parlare dell'evoluzione che le parti dell'atomo hanno avuto, da quando il modello atomico è cambiato nel tempo grazie agli studi degli scienziati. Va tenuto presente che molti dei modelli che andremo a spiegare sono obsoleti, non utilizzati allo stato attuale, ma sono necessarie per comprendere l'evoluzione della comunità scientifica su questo argomento.
L'evoluzione storica del modello atomico è caratterizzata da seguenti scienziati:
- Modello Dalton: Il primo modello atomico fu opera di John Dalton nel 1803. È un modello molto primitivo a cui mancano molti elementi come la presenza di elettroni e protoni.
- Modello Thomson: John Thomson è riuscito a realizzare un modello atomico più completo di quello di Dalton, aggiungendo diversi elementi chiave. Thomson scoprì l'esistenza di elettroni e cariche positive e negative.
- Modello di Nagaoka: Il fisico giapponese Nagaoka non era d'accordo con il modello di Thomson, pensava che l'atomo dovesse avere un grande nucleo caricato positivamente su cui ruotano gli elettroni caricati negativamente. La sua teoria è detta saturniana, poiché paragonava gli elettroni agli anelli di Saturno. Molte volte questo modello non viene nominato, ma è fondamentale per capire il grande passo che viene compiuto in questo momento.
- Modello di Rutherford: Il modello di Rutherford si basava sull'esistenza di un nucleo con carica positiva su cui ruotavano elettroni con carica negativa. Questo modello è molto simile a quello di Nagaoka, essendo di anni molto vicini, anche se il modello giapponese è precedente.
- Modello di Bohr: Bohr pensava che gli elettroni dovessero essere separati a grande distanza dal nucleo stratificato e che il numero di queste particelle orbitali dovesse essere uguale al numero atomico. Il suo modello comprende anche che il numero di elettroni varia in ciascun guscio, con meno elettroni nel primo guscio rispetto all'ultimo.
- Modello di Schrödinger: Schrodinger ha rotto la convinzione che gli elettroni siano minuscole particelle che ruotano attorno al nucleo. Lo scienziato austriaco sosteneva che gli elettroni si muovevano per mezzo di una funzione d'onda, cioè per forma orbitale.
- Modello Dirac: Dirac modificò le idee di Schrodinger per il suo modello, usando l'"equazione di Dirac" per dare una visione più corretta della forma orbitale degli elettroni.