Differenza tra acidi e basi forti e deboli (con esempi)
Una classificazione di acidi e basi in chimica dipende dalla forza di ionizzazione di queste sostanze in mezzo acquoso. R) Sì:
- un acido e una base sono forti quando sono completamente ionizzati, cioè nel processo di ionizzazione vengono completamente trasformati in cationi o ioni positivi e in anioni o ioni negativi.
- D'altro canto, un acido e una base sono deboli quando sono parzialmente ionizzati in acqua, cioè in soluzione ci sarà una proporzione di cationi, un'altra proporzione di anioni e un'altra proporzione di molecole indissociate.
| Acidi e basi forti | Acidi e basi deboli | |
|---|---|---|
| Definizione | Sostanze che ionizzano completamente in soluzione. | Sostanze che ionizzano parzialmente in soluzione. |
| Ionizzazione | Completare | Parziale |
| Elementi in soluzione acquosa | Cationi e anioni nella stessa concentrazione. | Cationi, anioni e molecole in diverse proporzioni. |
| Costante di ionizzazione | elevato | Poco |
| Esempi |
|
|
Acidi e basi forti
UN un acido o una base sono forti quando in un mezzo acquoso si dissociano completamenteIn altre parole, il processo di ionizzazione è completo e la soluzione conterrà la stessa concentrazione di anioni e cationi.
Come si ionizza un acido e una base forte?
Un acido forte, come l'acido cloridrico HCl, si ionizza nei seguenti modi:
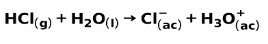
Una base forte, come l'idrossido di sodio NaOH, ionizza nei seguenti modi:
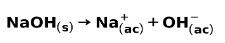
Esempi di acidi forti e loro formule
| Acidi forti | Formula |
|---|---|
| Acido cloridrico | HCl |
| Acido solforico | H2SW4 |
| L'acido nitrico | HNO3 |
| Acido bromidrico | HBr |
| Acido perclorico | HClO4 |
| acido cromico | H2Cro4 |
| Acido tetrafluroborico | HBF4 |
Esempi di basi forti e loro formule
| Base forte | Formula |
|---|---|
| Idrossido di sodio | NaOH |
| Idrossido di litio | LiOH |
| Idrossido di potassio | KOH |
| Idrossido di rubidio | RbOH |
| Idrossido di cesio | CsOH |
| Idrossido di calcio | Ca(OH)2 |
| Idrossido di bario | Ba (OH)2 |
| Idrossido di stronzio | Sr (OH)2 |
| Idrossido di alluminio | Al (OH)3 |
Potresti essere interessato a vedere di più esempi di acidi e basi.
Acidi e basi deboli
UN L'acido o la base è debole quando parzialmente ionizzato in soluzione acquosa, cioè nella soluzione ci sono ioni e molecole non ionizzate.
Come si ionizza un acido e una base debole?
Un acido debole, come l'acido acetico CH3COOH, viene ionizzato nel modo seguente:
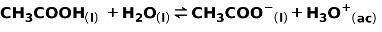
L'equilibrio di questa reazione è espresso dalle due frecce in direzioni opposte.
Quando un acido debole si dissocia o ionizza, si stabilisce un equilibrio tra le specie presenti nella soluzione; questo può essere espresso da a costante di ionizzazioneacido:
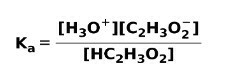
La costante di ionizzazione non è altro che il rapporto tra la moltiplicazione della concentrazione dei prodotti sulla moltiplicazione della concentrazione dei reagenti.
Una base debole, come NH ammoniaca3, viene ionizzato nel modo seguente:
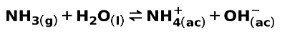
Quando una base debole si dissocia o si ionizza, si stabilisce un equilibrio tra le specie presenti nella soluzione; questo può essere espresso da a costante di ionizzazione di base:
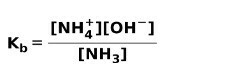
Potresti essere interessato a conoscere la differenza tra Acidi e basi.
Esempi di acidi deboli con la loro formula e costante di ionizzazione acida Kper
| acido debole | Formula | Costante di ionizzazione |
|---|---|---|
| Acido formico | H2CO2 | 1,77 x 10-4 |
| Acido acetico | H3CCOH | 1,75 x 10-5 |
| acido cianidrico | HOCN | 3.30 x 10-4 |
| Acido cianidrico | HCN | 6.20 x 10-10 |
| acido ipocloroso | HOCl | 3,50 x 10-8 |
| acido nitroso | HNO2 | 4,00 x 10-4 |
| Acido lattico | HC3H5O3 | 1,40 x 10-4 |
| Acido carbonico | H2CO3 |
4.30 x 10-7 5,60 x 10-11 |
| Acido borico | H3BO3 |
5,80 x 10-10 1,80 x 10-13 3,00 x 10-14 |
Esempi di basi deboli con la loro formula e costante di ionizzazione basica Kb
| Base debole | Formula | Costante di ionizzazione |
|---|---|---|
| Ammoniaca | NH3 | 1,75 x 10-5 |
| metilammina | CH3NH2 | 4.38 x 10-4 |
| etilammina | C2H5NH2 | 5,60 x 10-4 |
| Anilina | C6H5NH2 | 3,80 x 10-10 |
| piridina | C5H5no | 1,70 x 10-9 |
| benzilammina | C7H9no | 2,20 x 10-5 |
| Bicarbonato di sodio | NaHCO | 2,00 x 10-4 |
Potresti essere interessato a saperne di più su Caratteristiche di acidi e basi