Protoni, neutroni ed elettroni
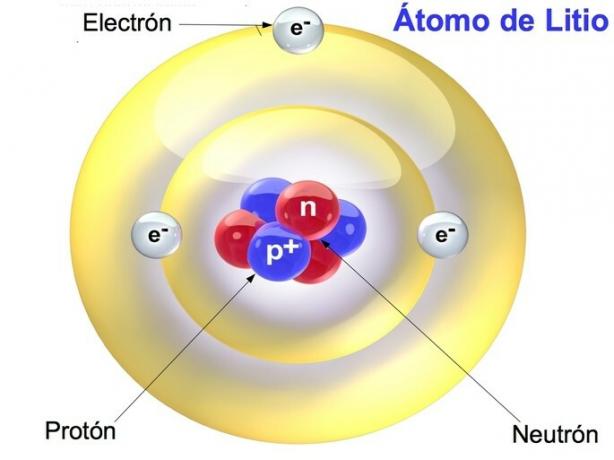
Protoni, neutroni ed elettroni sono le particelle che compongono l'atomo, che è la parte più piccola dell'elemento. Queste particelle determinano le caratteristiche e le proprietà degli elementi chimici.
I protoni ei neutroni sono concentrati nel nucleo atomico, mentre gli elettroni sono distribuiti nella crosta o alla periferia dell'atomo. Un atomo ha lo stesso numero di elettroni e protoni, mentre il numero di neutroni è variabile.
Successivamente, presentiamo una tabella comparativa tra protoni, neutroni ed elettroni.
| Protone | neutrone | elettrone | |
|---|---|---|---|
| Definizione | Particella subatomica di carica positiva | Particella di carica neutra subatomica | Particella subatomica con carica negativa |
| Caricare | Positivo +1 |
Neutro 0 |
Negativo -1 |
| Simbolo | p+ | n0 | e- |
| Posizione nell'atomo | Nucleo | Nucleo | orbitali periferici |
| Massa (kg) | 1.673x10-27kg | 1.675x10-27kg | 9.109x10-31kg |
| Massa rispetto al protone (amu) | 1 | 1 | 0,0005 |
| Particella elementare | 3 quark: 2 u e 1 d | 3 quark: 2 d e 1 u | 1 leptone |
| Scopritore (anno) | E. Rutherford (1911) | J. Chadwick (1931) | JJ Thomson (1897) |
Cos'è un protone?
I protoni sono le particelle cariche positivamente che si trovano nel nucleo di un atomo. Ogni atomo di un elemento ha un numero fisso di protoni, che ne determina il numero atomico, o Z. Quindi, l'idrogeno ha un protone e Z è uguale a 1.
La massa del protone è 1.673 x 10-27 kg, che rappresenta 1 unità di massa atomica o amu (per il suo acronimo in inglese unità di massa atomica).
Nel 1911, Ernest Rutherford scoprì che il nucleo di un atomo era minuscolo e carico positivamente, da qui il concetto di protone.
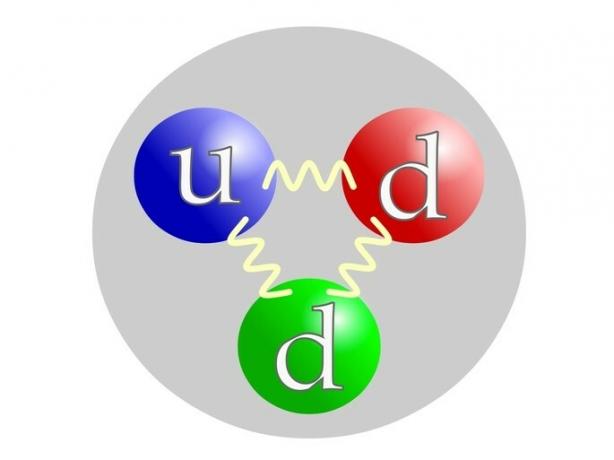
Il protone è costituito da particelle elementari chiamate quark o quark: 2 quark u (per su= alto) e 1 quartk d (di giù= giù).

Come calcolare i protoni di un atomo?
Il numero di protoni in un atomo può essere determinato dal suo numero atomico, che è il numero di posizione sulla tavola periodica.
Ad esempio, l'oro Au ha un numero atomico = 79, il che significa che l'oro ha 79 protoni nel suo nucleo.
Cos'è un neutrone?
I neutroni sono le particelle che si trovano nel nucleo di un atomo insieme ai protoni. Sono indicati con la lettera n e sono a carica neutra. L'unico elemento che non ha neutroni è l'idrogeno.
La massa dei neutroni è molto simile a quella dei protoni, quindi la somma delle masse dei protoni e dei neutroni determina la massa atomica di un elemento.
Gli atomi che hanno lo stesso numero atomico, ma un diverso numero di neutroni sono chiamati isotopi. Ad esempio, il deuterio è un isotopo dell'idrogeno, che ha un neutrone e un protone nel nucleo.
Il fisico inglese James Chadwick scoprì nel 1931 questa particella subatomica, con una massa vicina al protone, ma con una carica elettrica neutra, motivo per cui fu chiamata neutrone.
Il neutrone è composto come il protone dai quark: 1 quark u (by su= alto) e 2 quartk d (di giù= giù).
Come calcolare i neutroni di un atomo?
Possiamo calcolare il numero di neutroni in un atomo se conosciamo la sua massa atomica e il suo numero atomico Z. Sappiamo già che il numero atomico Z è il numero di protoni e la massa atomica è la somma di protoni e neutroni che ha un atomo.
Ad esempio, l'ossigeno ha una massa atomica di 16 e Z è 8. Il numero di protoni nell'ossigeno è uguale alla massa atomica meno Z:
16 - 8 = 8 neutroni
Cos'è un elettrone?
Gli elettroni sono le particelle dell'atomo che si trovano nella nuvola che circonda il nucleo. Mentre protoni e neutroni sono concentrati nel nucleo, gli elettroni sono distribuiti in strati all'esterno.
Gli elettroni nel guscio più esterno di un atomo possono saltare da un atomo all'altro. Questo dà all'atomo una diversa carica elettrica; per esempio, se un atomo acquista un elettrone, la sua carica sarà negativa, mentre se perde un elettrone, la sua carica sarà positiva.
Questo è ciò che accade negli ioni, cioè in un atomo che acquista o perde uno o più elettroni. Ad esempio, il cloro ha 17 elettroni, ma può guadagnare un elettrone per diventare un anione cloruro di Cl.-, con 18 elettroni e carica negativa.
L'elettrone fu scoperto nel 1897 da J.J. Thomson, lo stesso uomo del modello atomico "budino all'uvetta".
L'elettrone è costituito da una particella elementare che è il leptone.
La massa di un elettrone è quasi 2000 volte più piccola di quella del protone e del neutrone. Supponiamo che un protone o un neutrone abbia le dimensioni di una palla da bowling di 10 libbre, allora l'elettrone avrebbe le dimensioni di una biglia.
Pertanto, la massa degli elettroni in un atomo è trascurabile quando si calcola la massa atomica.
Come calcolare gli elettroni di un atomo?
Il numero di elettroni in un atomo neutro è uguale al numero di protoni in quell'atomo. Ad esempio, l'oro Au ha 79 protoni, quindi avrà 79 elettroni.
Potrebbe interessarti anche vedere:
- Cationi e anioni
- Atomi e molecole.
Riferimenti
Myers, R.L. (2005) Le basi della fisica. Greenwood.
Peake, B.M. (1989) La scoperta dell'elettrone, del protone e del neutrone. J. Educazione chimica 66: 738. DOI: 10.1021/ed066p738