האבולוציה של הטבלה הפריודית: מיצירתה ועד היום
הטבלה המחזורית היא אחת מה- הסמלים האיקוניים ביותר של המדע. אף על פי ששנת 2019 הייתה יום השנה ה 150 להיווסדה, היא בשום פנים ואופן לא מסמך מוגמר. בשיעור זה של מורה נראה מה ה התפתחות הטבלה המחזורית מיצירתו ועד ימינו ומה ההתקדמות בידע האטומים ותכונותיהם אפשרו זאת.
אינדקס
- מהי הטבלה המחזורית?
- טבלה מחזורית ראשונה: המקור
- היסטוריה של הטבלה המחזורית והאבולוציה
מהי הטבלה המחזורית?
ה טבלה מחזורית מערכת היסודות התקופתית היא המסמך המדעי שמרכז יותר מידע בפחות מקום ומהווה את אחד האייקונים החזקים ביותר של המדע. הוא מכיל חלק טוב מה- ידע שיש לנו על כימיה. אין מסמך דומה בשום תחום מדעי אחר.
הטבלה המחזורית של האלמנטים היא א מערכת סיווג של יסודות כימיים זה התחיל לפני יותר מ 200 שנה. מערכת סיווג זו גדלה ומשתנה עם הזמן, ככל שהמדע התקדם והתגלו חדשים. יסודות כימיים. עם זאת, השינויים השונים שולבו תוך שמירה על מבנה היסוד שלו ללא פגע.
הטבלה המחזורית נקראת כך משום מבטא בצורה גרפית באופן שבו הם חוזרים על עצמם במרווחי זמן קבועים תכונות כימיות. זהו סוג של ייצוג דו מימדי או, בייצוגיו המודרניים יותר, תלת מימד.
בתוך ה טבלה מחזורית קלאסית (דו ממדי) היסודות הכימיים מסודרים ב קבוצות או משפחות ומיוצגים בטבלה המחזורית הנוכחית בעמודות אנכיות. הסידור המסודר של קבוצות אלה בטורים מוליד סדרה של שורות, הנקראות תקופות, בהן היסודות מסודרים על פי משקלם האטומי. הטבלה המחזורית מורכבת משבע תקופות המשתנות באורכן.

טבלה מחזורית ראשונה: המקור.
לפני מנדלייב, מדענים אחרים פיתחו מערכות סיווג עבור יסודות כימיים. אבל, בניגוד לטבלה המחזורית של האלמנטים, הם היו רק רשימות של היסודות הידועים; בעוד שלטבלה המחזורית יש את המוזרות שהיא מערכת סיווג בשני ממדים (שורות ועמודים) או תלת מימד, בגרסאותיו המודרניות ביותר, כאשר היסודות הכימיים מסודרים ברצף שכבות.
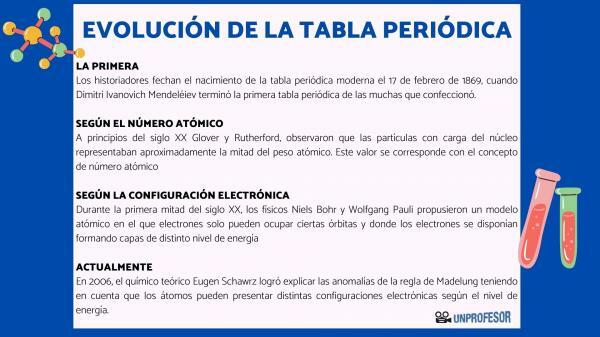
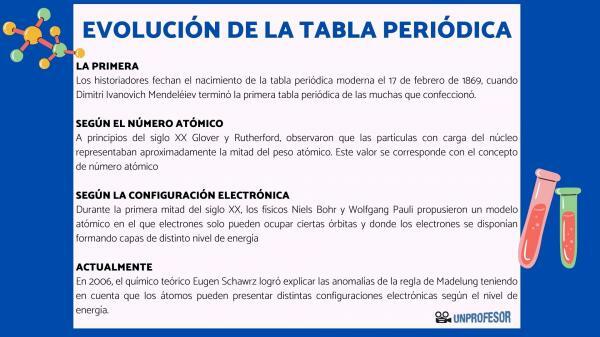
מסיבה זו, היסטוריונים מתארכים את לידת הטבלה המחזורית המודרנית 17 בפברואר 1869, מתי דימיטרי איבנוביץ 'מנדלייב לסיים את ה טבלה מחזורית ראשונה מהרבים שהוא עשה. טבלה זו כללה 63 אלמנטים המסודרים במשפחות והשאירה חללים ריקים לאלמנטים שעדיין לא גילה, אך ממנו הסיק את משקלם האטומי (כמו במקרה של גליום, גרמניום ו סקנדיום)
נתוני המפתח לגילוי הטבלה המחזורית היו הידע הקודם של ה- משקל אטומי של כל אלמנט.
מהו משקל אטומי ומספר אטומי?
המספר הזה ייצג את משקל האטום וזה היה הערך היחיד הניתן למדידה של אטומים. אבל זה לא היה בשום מקרה של מדידות ישירות (אין מכשירי מדידה שמאפשרים שקילה של אטומים מבודדים) אלא הם היו מערכת שהקימה תקן בו ניתן ערך שרירותי של 1 לאטום המימן ואת ערך המשקל האטומי של האלמנטים הנותרים מחושב ביחס לזה תבנית.
החישובים הראשונים של מספר אטומי מהאלמנטים בוצעו על ידי הכימאי האנגלי ג'ון דלטון, ויצר דיון מדעי נהדר במחצית הראשונה של המאה ה -19. עם זאת, במחצית השנייה של המאה ה -19, כבר היה קונצנזוס יוצא דופן על מערכת חישוב המשקל האטומי של היסודות. המשקל האטומי הפך ממנדלייב ואילך, קריטריון מפתח לסדר נכון של היסודות בטבלה המחזורית.
כאשר מנדלב הזמין את האלמנטים הידועים על פי שלהם הגדלת משקל האטום, צפה במראה של מאפיינים חוזרים המאפשרים לקבץ את האלמנטים לקבוצות או למשפחות של אלמנטים שדומים זה לזה. עם זאת, במקרים מסוימים, סידור היסודות על פי משקלם האטומי לא הגיב לדמיון בין היסודות שנצפו ומנדלייב השתנה. מיקומם של 17 יסודות בסידור הטבלה המחזורית למרות משקלם האטומי, כדי להיות מסוגל לקבץ אותם באותם יסודות שהם הציגו אנלוגיות.
שינויים אלה הראו שחלק ממשקולות האטום המקובלות לא היו נכונות וחושבו מחדש. למרות התיקונים במשקלי האטום, היו עדיין אלמנטים שהיו צריכים להיות ממוקמים במיקומים אחרים מאלה שמצוין על ידי משקליהם האטומיים.

תמונה: BBC.com
היסטוריה של הטבלה המחזורית והאבולוציה.
למרות תרומתו הבלתי מעורערת של מנדלב, הטבלה המחזורית של היסודות אינה תוצאה של עבודתו של חוקר אחד. בנוסף למנדלייב, במהלך המחצית השנייה של המאה התשע עשרה ולאורך המאה העשרים רבים כימאים המשיכו לחקור את הדרך הטובה ביותר לארגן מידע על יסודות כימיים ידוע. יותר מכך בהתחשב בכך שבזמן זה הגילוי של יסודות כימיים חדשים או חומרים פשוטים, הודות לספקטרומטריה (החוקרת את יחסי הגומלין בין אטומים לקרינה אלקטרומגנטית).
ה סיווג יסודות בטבלה המחזורית התבסס בתחילה על חישובי ההתחלה של משקולות אטומיים של היסודות וחשף אנלוגיות שאפשרו לקבץ את האלמנטים למשפחות אנלוגיות. למרות זאת, לא ניתן היה להסביר את הסיבה להופעתם של מאפיינים תקופתיים אלה. זה היה לאורך המאה ה -20, עם גילוי המבנה האלקטרוני, כאשר הסיבה למחזוריות זו בתכונות האלמנטים הובנה.
המספר האטומי כסדר מיון
בתחילת המאה ה -20 גלובר ורותרפורד, ציין כי החלקיקים הטעונים בגרעין היוו כמחצית ממשקל האטום. ערך זה תואם את המושג מספר אטומי שמוגדר כמספר הפרוטונים בגרעין האטום ואשר עולה בקנה אחד עם מספר האלקטרונים באטום ניטרלי. ערך חדש זה הצדיק את שינויי המיקום של אלמנטים מסוימים שבוצעו עד אז. למשל שינוי העמדה בין טלוריום ליוד.
בשנת 1913, הנרי מוזלי אישר את הזמנת הטבלה כפונקציה של מספר אטומי באמצעות ספקטרומטריית רנטגן. הסדר לפי המספר האטומי עדיין בתוקף כיום.
במקביל, במהלך המאה ה -20, המשיכו להתגלות יסודות כימיים חדשים בזכות מכניקת הקוונטים ופיתוח הטכניקה של הפצצת אטומים על ידי חלקיקים, מהמחצית השנייה של המאה. בעזרת טכניקה חדשה זו ניתן היה ליצור אלמנטים מלאכותיים שאינם קיימים בטבע.
למרות שהושגה התקדמות בסידור הנכון של האלמנטים בטבלה המחזורית, עדיין הסיבה להתרחשות חוזרת של מאפיינים מסוימים (המאפיינים תְקוּפָתִי). התפתחות ה מכניקה קוואנטית (ענף פיסיקה החוקר את התנהגות האור והאטומים בקנה מידה מיקרוסקופי) משנת 1920 היה מכריע להסביר את הסיבה לתכונות אלה.
תצורה אלקטרונית כהסבר על מאפיינים תקופתיים
במחצית הראשונה של המאה ה -20, פיזיקאים נילס בוהר י וולפגנג פאולי הם הציעו מודל אטומי שבו אלקטרונים יכולים לכבוש מסלולים מסוימים בלבד ושם האלקטרונים מסודרים ויוצרים שכבות ברמות אנרגיה שונות. אופן חלוקתם של האלקטרונים במסלולים בקליפות או ברמות האנרגיה השונות מכונה תצורה אלקטרונית.
גילוי סידור האלקטרונים בתצורות אלקטרונים היה בסיסי להבנת המחזוריות של המאפיינים. תקופתית, שכן נצפה כי תכונות אלה קשורות קשר הדוק לתצורה האלקטרונית החיצונית ביותר של האטומים (שכבת ולנסיה).
הסדר שבו מילוי האלקטרונים אורביטלים אטומיים נקבע בשנת 1930 על ידי הפיזיקאי ארווין מדלונג שקבע כלל מספרי לסדר המילוי. כלל זה מכונה שלטון מדלונג וזה כלל אמפירי שלא ניתן היה להסבירו באמצעות מכניקת קוונטים.
רצף המילוי פשוט בשלוש השורות הראשונות בטבלה המחזורית, אך ב- שורה רביעית, בה נמצאים אלמנטים המעבר, סדר המילוי עובר סדרה של שינויים. ישנם בסך הכל 20 פריטים חריגים שאינם עומדים בכלל זה.
האבולוציה של השולחן נמשכת גם היום
בשנת 2006, הכימאי התיאורטי יוגן שוורץ הוא הצליח להסביר את חריגות השלטון של מדלונג תוך התחשבות בכך שלאטומים יכולים להיות תצורות אלקטרוניות שונות בהתאם לרמת האנרגיה. בחישוב הממוצעים, תצורות האלקטרונים של רוב האלמנטים תואמות את הכלל של מדלונג.
הטבלה המחזורית נותרה עניין של ויכוח במאה ה -21, אם כי הסידור או התצורה האלקטרונית של את האלמנטים, עדיין תקף להסביר את הסדר הזה ואת החריגות שנצפו בתצורות האלקטרוניות באמצעות א תֵאוֹרִיָה.
אם אתה רוצה לקרוא מאמרים נוספים הדומים ל- התפתחות הטבלה המחזורית - סיכוםאנו ממליצים לך להיכנס לקטגוריה שלנו האטום.
בִּיבּלִיוֹגְרָפִיָה
מחברים שונים. (2019)מיוחד: הטבלה המחזורית. מחקר ומדע. ברצלונה: עיתונות מדעית S.A.



