לשם מה נועדה הטבלה הפריודית?
הטבלה המחזורית היא מערכת סיווג לאלמנטים אטומיים שהומצאה בשנת 1869 על ידי הכימאי הרוסי דמיטרי מנדלייב ומאוחר יותר התארגן והתעדכן על ידי כימאים אחרים עד שהגיע להופעתו נוֹכְחִי. למרות היותו כלי שהוכיח את עצמו כשימושי לאורך ההיסטוריה (לכן הוא המשיך להיות בשימוש ועדכון), הוא א כל כך מייגע ללמוד ולהבין, ולכן כולנו שאלנו את עצמנו את השאלה "בשביל מה השולחן? תקופתי? ".
אם אתה רוצה לדעת בשביל מה הטבלה המחזורית ומדוע חשוב להבין את תכונותיו, המשך לקרוא שיעור זה ממורה.
אינדקס
- סיווג הטבלה המחזורית
- מצא את השם או הסמל של אלמנט עם הטבלה המחזורית
- דע את המסה האטומית של יסוד
- דע את המספר האטומי של יסוד
- חזו את הרדיוס האטומי של יסוד
- השווה את אנרגיית היינון של שני אלמנטים
- מציאת אלקטרונטיביות של יסוד כימי
- השווה בין הזיקה האלקטרונית של שני אלמנטים
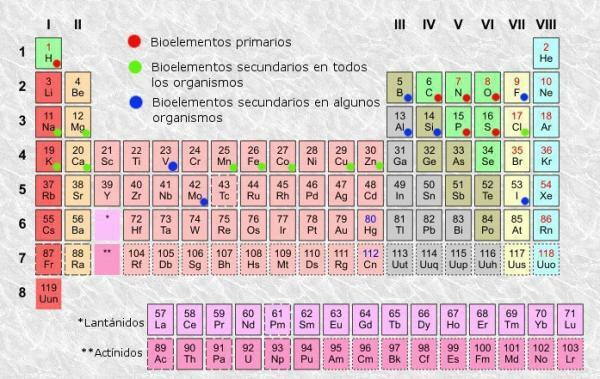
סיווג הטבלה המחזורית.
כמו בכל טבלה, ב הטבלה המחזורית מהאלמנטים נוכל להבחין בין עמודות (אנכיות) ושורות (אופקיות). בטבלה המחזורית יש 18 עמודות או קבוצות ו -7 שורות או תקופות.
בנוסף, תוכל לאמת שבדרך כלל בתוך כל אחת מהתיבות בטבלה מופיע לפחות המידע הבא:
- סמל יסוד כימי: קיצורים או סימנים המשמשים לזיהוי האלמנטים. הם מורכבים בדרך כלל מאות או שתי אותיות, שהראשונה תמיד באותיות רישיות.
- שם יסוד כימי: שם היסוד הכימי המתאים לקיצור העליון. זה בדרך כלל מתחת לסמל.
- מספר אטומי: המספר הכולל של פרוטונים שיש לכל אטום מאותו יסוד. בדרך כלל הוא מופיע בפינה השמאלית העליונה של תיבת הפריט (או בפינה השמאלית העליונה של טבלאות שלמות יותר).
- מסה אטומית: מסה של אטום יכולה בדרך כלל להיחשב כמסה הכוללת של פרוטונים ונויטרונים באטום יחיד. הוא זמין מתחת לשם האלמנט בטבלאות הפשוטות ביותר, אם כי באחרים הוא עשוי להופיע בחלק הימני העליון של תיבת האלמנטים.
ישנן טבלאות מחזוריות הכוללות סוגים אחרים של מידע מורכב וספציפי יותר כגון מצבי חמצון (שימושי לניסוח תרכובות כימיות, למשל), אנרגיית יינון, אלקטרונטיביות וכו ', אך טבלאות מחזוריות בסיסיות בדרך כלל לתת מספיק מידע ולרוב הם מספיקים למשתמש הממוצע, שממנו הוא יכול לגלות מידע כמו זה שנספר לך להלן.

גלה את השם או הסמל של אלמנט עם הטבלה המחזורית.
לפעמים אנו מכירים את סמל יסוד כימי אבל אנחנו לא יודעים את שמו. בזמנים אחרים אנו מכירים את שם היסוד הכימי, אך לא הקיצור או הסמל שלו. למעשה, קל מאוד שזה קרה לך אי פעם בכיתה.
במקרים אלה, אנו יכולים להשתמש בטבלה מחזורית, ללא צורך שהיא מורכבת, ולהתייעץ עם הנתונים החסרים במהירות ובדייקנות.
דע את המסה האטומית של יסוד.
לפעמים אנו מכירים את היסוד הכימי שאיתו אנו עוסקים, אך עלינו לדעת אותו מסה אטומיתכלומר, עד כמה שוקל אטום מאותו יסוד.
מידע זה יהיה שימושי, למשל בעת ביצוע המשימות הבאות:
- חשב את הכמות הספציפית של חומר.
- ניתוח התוצאות שהתקבלו במבחנים או בניסויים.
- חשב את אחוז המסה.
- הבן את המסה הטוחנת המדויקת של מולקולות מורכבות.
דע את המספר האטומי של יסוד.
המספר האטומי הוא המספר הכולל של פרוטונים שיש לאטום של יסוד. באטום ניטרלי חשמלי, מלבד קטיון (טעון חיובי, עם אלקטרון אחד פחות ממצבו הרגיל) או אניון (טעון שלילית, עם אלקטרון אחד יותר ממצבו הרגיל), מספר הפרוטונים שווה לזה של אלקטרונים.
מספר הפרוטונים הוא הגורם המכריע בכל הנוגע להבחנה בין יסוד זה לזה, מכיוון שמספר האלקטרונים או הנויטרונים אינו משנה את סוג היסוד.

חזו את הרדיוס האטומי של יסוד.
רדיוס האטום הוא חצי מהמרחק בין מרכזם של שני אטומים מאותו יסוד שבקושי נוגעים זה בזה. במקרה זה, דע את מיקום של יסוד כימי בטבלה המחזורית זה יכול לעזור לנו לגלות את הרדיוס האטומי המשוער שלו או בהשוואה לאלמנט אחר. לשם כך עלינו לדעת זאת הרדיוס האטומי:
- זה גדל ככל שעוברים מלמעלה לתחתית הטבלה המחזורית.
- הוא יורד כשאנחנו עוברים משמאל לימין דרך הטבלה המחזורית.
באופן זה, הסידן קטן מרובידיום אך גדול מברזל.
למידע נוסף על מהו הרדיוס האטומי עם שיעור הווידיאו האחר הזה של מורה.
השווה את אנרגיית היינון של שני אלמנטים.
ה אנרגיית יינון האם ה אנרגיה הנדרשת להסרת אלקטרון מאטום היסוד. במקרה זה, אם נדע את מיקומם של שני יסודות בטבלה המחזורית, נוכל לדעת איזה יסוד יהיה קל יותר "להסיר" אלקטרון. נצטרך לקחת בחשבון רק את הדברים הבאים:
- אנרגיית היינון פוחתת ככל שהיא נעה מעלה ומטה בטבלה המחזורית.
- אנרגיית היינון עולה ככל שעוברים משמאל לימין לטבלה המחזורית.
בין בריליום לחמצן, לחמצן יש יותר אנרגיית יינון. אם נשווה חמצן וגופרית, הנמצאים באותה קבוצה אך בתקופה הבאה, לחמצן יש גם אנרגיית יינון גבוהה יותר מכיוון שהוא גבוה יותר בטבלה המחזורית.
מצא את האלקטרואנגטיביות של יסוד כימי.
שליליות אלקטרונית האם ה יכולתו של אטום למשוך אלקטרונים. בפועל זה מתורגם ליכולת ליצור קשר כימי. כדי לדעת אם לאלמנט כימי יכולת רבה ליצור קשר כימי או לא, עלינו רק לקחת בחשבון את התבנית הבאה בטבלה המחזורית, כלומר:
- הוא יורד כשהוא נע מעלה ומטה.
- זה עולה ככל שעוברים משמאל לימין.
כמו במקרה הקודם, חמצן יותר אלקטרוני שלילי מבריליום וגופרית שכן הוא נמצא יותר ימינה מאשר הראשון וגבוה יותר מגופרית.

השווה בין הזיקה האלקטרונית של שני אלמנטים.
ה זיקה אלקטרונית האם הוא שינוי באנרגיה שעובר אטום ניטרלי כאשר הוא מושך אלקטרון להפוך ליון שלילי. במקרה זה, הזיקה האלקטרונית אינה משתנה בדיוק כמו במקרים הקודמים, אם כי אנו יכולים לומר שבאופן כללי, הזיקה האלקטרונית:
- הוא עולה, באותה תקופה, משמאל לימין.
- נעלה, באותה קבוצה, מלמטה למעלה.
אם אתה רוצה לקרוא מאמרים נוספים הדומים ל- לשם מה נועדה הטבלה המחזורית?אנו ממליצים לך להיכנס לקטגוריה שלנו האטום.
הפניות
האם יש לך קלט או הערה לשימושים בטבלה המחזורית? אל תהסס להשאיר אותו במדור התגובות שלנו! אהבתם את המאמר הזה? אתה יכול גם להשאיר את הדירוג שלך למטה!