כל המאפיינים של ה- ATOM

תמונה: SlideShare
למרות שאנחנו לא מסוגלים לראות אותם בעין בלתי מזוינת, אטומים הם חלק מכל החומר של הפלנטה שלנו. כל החומר עשוי אטומים, שמתאגדים יחד ויוצרים יסודות כימיים, מולקולות, תרכובות וכו '. האטום מוגדר כ- היחידה הבסיסית הקטנה ביותר של חומר שיש לו תכונות של יסוד כימי. כל יסוד כימי מוגדר על ידי סוג האטום ממנו הוא עשוי, ולכן השאלה האחרונה היא: אילו תכונות יש לאטום? בשיעור זה של מורה נסקור את תכונות האטום ההופכים כל אטום לאופייני ליסוד כימי.
אינדקס
- מהו האטום?
- מספר אטומי, מספר מסה ואיזוטופים
- צפיפות, תכונה נוספת של האטום
- רדיוס יוני ורדיוס Vanderwalls
- אנרגיית יינון
מהו האטום?
לפני הכניסה לניתוח תכונות האטום חשוב שנדע טוב יותר במה מדובר. ה אָטוֹם היא יחידה שנוצרת על ידי שלושה חלקיקים תת-אטומיים: פרוטונים, נויטרונים ואלקטרונים. אלה מאורגנים בגרעין ובקליפת המוח.
- ה הליבה זה מורכב פרוטונים י נויטרונים, שנמצא במרכז האטום, ואחראי על רוב משקל האטום; פרוטונים טעונים באופן חיובי, בעוד שנויטרונים הם ניטרליים כך שהגרעין טעון חיובי.
- ה קליפת המוח נוצר על ידי אלקטרונים, שהם חלקיקים קטנים וטעונים שלילית המסתובבים סביב הגרעין ויוצרים מסלולים (כמו זה של כוכבי הלכת) אך מבלי ליפול לעולם לגרעין האטום. קליפת המוח של האטום אחראית על אינטראקציה עם קליפת המוח של האטומים האחרים מכיוון שהוא ממוקם בחלק החיצוני של האטומים.
האטומים השונים מורכבים מפרוטונים, נויטרונים ואלקטרונים, זהים בכל היסודות הכימיים. אז מה הופך שם לאלמנטים כימיים שונים? מספר הפרוטונים, הנויטרונים והאלקטרונים שמהם מורכבים האטומים של כל יסוד הוא שונה וזה גורם בתורו לכל יסוד תכונות או אחרים.

תמונה: SlideShare
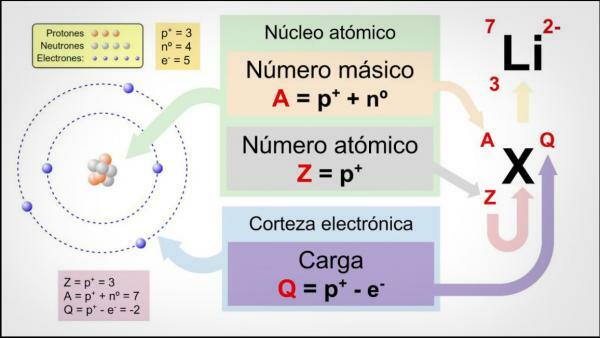
המספר האטומי, מספר המסה והאיזוטופים.
שלושת המאפיינים הראשונים קשורים ישירות למספר החלקיקים המרכיבים את האטום של כל יסוד.
ה מספר אטומי (Z) מציין את מספר הפרוטונים המרכיבים את גרעין האטום. כך, למשל, בכל אטומי הברזל יהיו בגרעין 26 פרוטונים. בנוסף, אם הם לא אומרים לנו אחרת, היסודות הכימיים נמצאים במצב ניטרלי, כלומר מטען חיובי (פרוטונים) ושלילי (אלקטרונים) זהה, כך שלכולם יהיה גם 26 אלקטרונים.
ה מספר מסה אוֹ משקל אטומי (A) מציין את המספר הכולל של פרוטונים ונויטרונים המרכיבים את גרעין האטום. כפי שכבר ציינו בעבר, משקל האלקטרונים הוא כמעט זניח בהשוואה לזה של האלקטרונים. פרוטונים ונויטרונים, כך שמספר המסה מציין בעקיפין את משקל האטום המדובר. בהמשך לדוגמא של ברזל, אם תתייעץ בטבלה המחזורית של האלמנטים תראה שהמשקל האטום של יסוד זה הוא 55.85, כלומר לכל האטומים של אותו יסוד יהיה את זה מִשׁקָל.
סוף - סוף, ה איזוטופים של יסוד כימי הם גרסאות של אותו אטום (כלומר, יש להם אותו מספר אטומי) אך מספר מסה שונה, כלומר, מספר שונה של נויטרונים. ברוב היסודות הכימיים יש יותר מאיזוטופ טבעי אחד, היסוד בעל הכמות הגבוהה ביותר של איזוטופים יציבים הוא פח (Sn), בעל 10 איזוטופים טבעיים שונים.
תמונה: ConceptDefinition.de
צפיפות, תכונה נוספת של האטום.
ה צְפִיפוּת של אטום הוא מספר יחידות המסה (אומה) של היסוד שנמצא בנפח מסוים של שטח. הצפיפות של כל חומר מסומלת באמצעות האות היוונית "Ro" (כתוב r) ויחידותיה על פי מערכת היחידות הבינלאומית (SI) הן קילוגרם למ"ק (ק"ג / מ"ק). במקרה של יסודות כימיים, שהם קטנים כל כך, הגרם לסנטימטר מעוקב (גרם / ס"מ3).
כדי לחשב את צפיפות האטום (צפיפות אטומית), נצטרך לקחת בחשבון את מסת האטום ואת נפחו. בעוד שרוב המסה של האטום נמצאת בגרעין של אותו הדבר, הנפח צריך לעשות עם כמה הגדול האטום, ולכן מספר האורביטלים האלקטרוניים ישחק תפקיד חָשׁוּב. אם ניקח בחשבון מאפיינים אלה ונטייתם במערכת התקופתית, אנו יכולים לראות כי ה הצפיפות עולה ככל שאנחנו גדלים בקבוצה וגם עולה ככל שאנחנו מתקרבים לחלק המרכזי של ה טבלה מחזורית.
תמונה: יוטיוב
רדיוס יוני ורדיוס Vanderwalls.
ה רדיוס יוני הוא הרדיוס שיש ליון של יסוד במצב הגביש היוני. במצב זה, היונים קרובים כל כך זה לזה שהמסלולים האלקטרוניים החיצוניים ביותר נמצאים במגע אחד עם השני.
מצד שני, ה רדיוס וונדרוואלס הוא המרחק ששני האטומים נשמרים זה מזה בגלל דחיית מטענים שליליים בין האלקטרונים של כל אחד מהאטומים. רדיוס ה- Vanderwalls יהיה הרדיוס של כדור מוצק דמיוני המשמש לדגם האטום ולכן הוא אינו משמש הרבה בתרגול היומיומי.
בניגוד למה שקורה בצפיפות או במסה, שני המאפיינים הללו קשורים זה לזה עם נפח האטום, כלומר יש להם יותר קשר למספר האלקטרונים בו מאשר ל הליבה.

תמונה: SlidePlayer
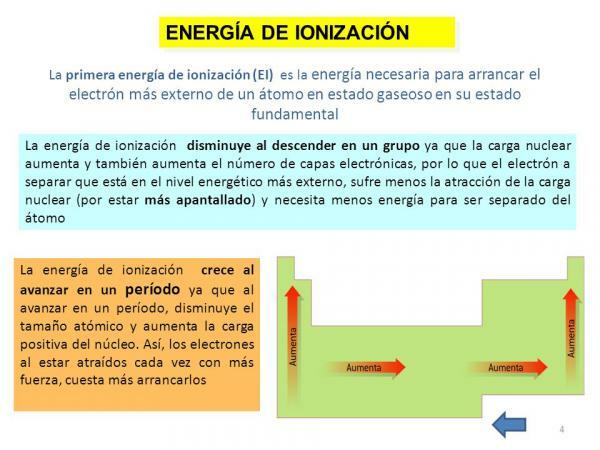
אנרגיית יינון.
לבסוף, תכונה נוספת של האטום היא אנרגיית יינון, מאפיין המספר לנו את האנרגיה הדרושה לנו כדי להפריד בין אלקטרון במצב הקרקע שלו (למעט אניון או קטיון) של אטום של יסוד במצב גזי, אך ניתן להגדירו גם ככוח שאיתו נקשר אלקטרון עם אחרים מולקולות. מאפיין זה מעניין מאוד מכיוון שהוא מאפשר לנו לקבל מושג גס על ה יכולת תגובה של אטום של יסוד כימי מסוים. אנרגיית היינון גבוהה יותר ככל שאנו מסירים אלקטרונים, כך שלאלמנט יש אנרגיה של יינון ראשון, אנרגיית יינון שנייה, וכן הלאה והם הולכים וגדלים.
כמו במקרה הקודם, מאפיין זה קשור קשר הדוק גם למספר האורביטלים של ה- היסוד המדובר הואיל וככל שיש לו פחות אורביטלים, כך יעלה הוצאת האלקטרונים מאטום נחוש בדעתו.
תמונה: SlidePlayer
אם אתה רוצה לקרוא מאמרים נוספים הדומים ל- נכסי אטוםאנו ממליצים לך להיכנס לקטגוריה שלנו האטום.


