正または負のイオンの定義

すでに知っているように、 原子 それらはによって形成されます 亜原子粒子. 3種類の亜原子粒子のうち、中性子だけが電荷を持っていません。 代わりに、陽子は正の電荷を持ち、電子は負の電荷を持ちます。 原子の周辺を占める電子だけが、ある原子から別の原子に移動できますが、原子核内の陽子はその数を安定させます。 教師からのこのレッスンでは、原子または分子が電子を獲得または喪失したときに何が起こるかを見ていきます。 つまり、 陽イオンまたは陰イオンの定義と例。
インデックス
- イオンとは何ですか? 簡単な定義
- イオン形成:電気親和性と電気陰性度
- マイナスイオンとは? 例を挙げて
- 陽イオンとは何ですか? 例を挙げて
イオンとは何ですか? 簡単な定義。
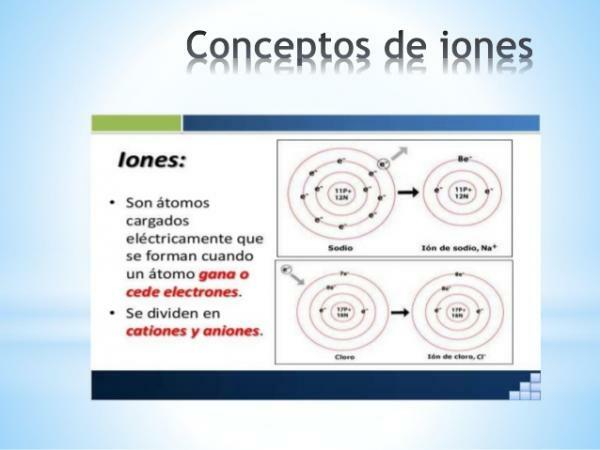
A イオン あります 正味電荷を持つ原子または分子. つまり、それは互いにリンクされた原子または原子のセットであり、その電荷は 補償されません. この電荷の代償不全は、1つまたは複数の電子が原子または原子のセットに参加または離脱するときに発生します。
したがって、イオンは 荷電原子または分子、 電子の獲得または喪失(負の電荷とごくわずかな質量を持つ亜原子粒子)による。
イオンタイプ:単原子および多原子
イオンの組成を考慮すると、単原子イオンと多原子イオンの2つのタイプが区別されます。
- 名前が示すように、 単原子イオン によって形成されるもの 単一原子.
- イオン性化合物o 多原子イオン 原子が共有結合している(結合内の1つまたは複数の電子対を共有している)もので、 中性子 電子の総数とは異なる分子内。
- ザ・ 多原子イオン それらは通常含まれています 酸素 そしてそれらは通常、分子を構成する残りの要素がその周りに配置されている中心原子を持つ構造を持っています。
- ザ・ 単原子イオンの電荷 代表元素(周期表のファミリー1と2、周期表のファミリー13から17)の位置がわかれば、簡単に推測できます。 これらの場合、原子は、価電子殻内でその周期の希ガスの配置に到達するために電子を獲得または喪失します(s2p6)、または同じことは、 オクテット則.
画像:Slideshare
イオン形成:電気親和性と電気陰性度。
原子または分子の能力 イオンを形成する 2つの周期的特性によって決定されます。 電気親和性と電気陰性度. 両方のプロパティは、ある期間にわたって値が増加し、周期表のグループまたはファミリを下るにつれて減少します。
ザ・ 電気親和性、は電子親和力とも呼ばれ、原子が電子を引き付ける能力として定義される原子特性です。 化合物の場合、 電気陰性度 これは、原子が別の原子と結合を形成するときに電子を引き付ける能力として定義されます。 したがって、両方の特性は、要素が電子を捕獲または喪失する傾向を定義します。
イオン結合
それらの固体形態では、イオンは化合物を形成するか、 イオン結晶 (塩)、によって結合された異なる符号のイオンの組み合わせによって形成されます イオン結合. このタイプの化合物の最もよく知られている例は、一般的な塩(塩化ナトリウム:NaCl)です。
イオン結合は、静電引力(反対の符号の電荷間の引力)による異なる符号のイオンの結合で構成されます。 このタイプのリンクには、電気陰性度または電気親和力が大きく異なる元素(金属元素と非金属元素)が介入します。 ほとんどの場合、これらのイオン性化合物は 水に溶ける およびその他の極性溶媒。
水溶液中では、イオン性化合物が解離して遊離イオンになります。 電解質、溶液中に存在すると、水が導電体として動作するためです。
マイナスイオンとは? 例を挙げて。
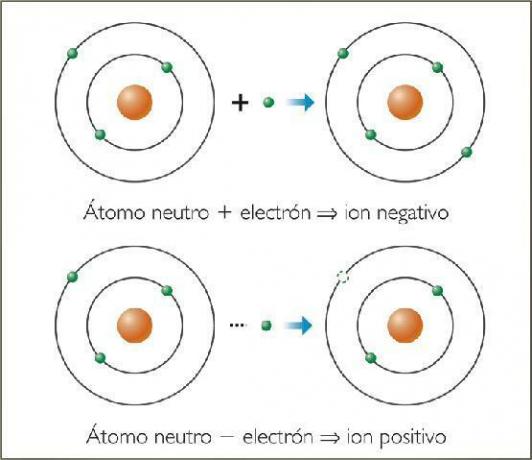
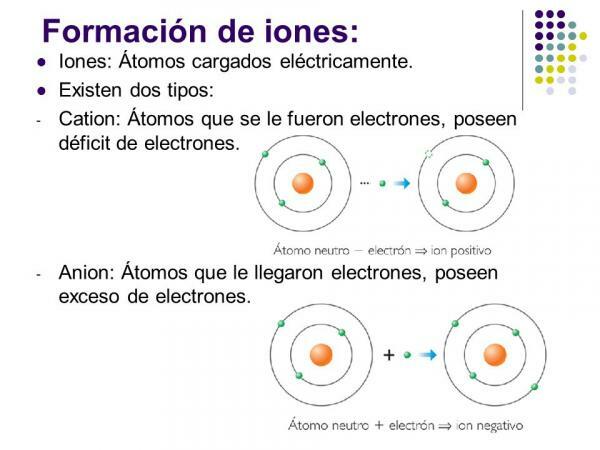
ザ・ マイナスイオン という 陰イオン. すべての場合において、それらは非金属元素の原子または非金属元素を含む分子です。 これらの元素は、非常に高い電気親和力と電気陰性度を持っていることを特徴としています。 つまり、それらは次の元素によって形成されるイオンです。 電子を捕獲する傾向が高い.
単原子アニオン:定義と例
それらは、1つまたは複数の電子を獲得した非金属元素(周期表のグループ13から17)の原子によって形成される陰イオンです。 これらの陰イオンは、共通して希ガスの電子構造を持っています(s2p6)その最も外側の電子殻(価電子殻)。
例:
- 塩化物イオン:Cl-
- フッ化物イオン:F-
- ヨウ化物イオン:I-
- 硫化物イオン:S-2
- 窒化物イオン:N-3
多原子アニオン:定義と例
それらは、共有結合によって結合された非金属元素の2つ以上の原子によって形成された負に帯電したイオンです。 それらは最も一般的な多原子イオンです。 最も一般的な多原子アニオンはオキソアニオンであり、これは中央の非金属原子で構成され、酸素を含んでいます。
一般に、それらは酸性化合物が1つ以上のプロトン(H+). これらの多原子アニオンは、その構造にいくらかの水素を保持することができ、それによって特定の酸特性(プロトンを放出する能力)が与えられます。
例:
- 硝酸イオン:NO3-
- 過マンガン酸イオン:MnO4-
- リン酸イオン:PO4-3
- 炭酸水素イオンまたは重炭酸イオン:HCO3-
- 亜硫酸イオン:SO3-2
画像:自然療法
陽イオンとは何ですか? 例を挙げて。
陽イオンは cations. ほとんどの場合、それらは金属元素の原子または金属元素を含む分子です。 これらの元素は、電気親和力と電気陰性度が非常に低いという特徴があります。そのため、電子を失う傾向がはっきりと示されています。
単原子カチオン:定義と例
それらは、金属元素の単一の原子によって形成された正電荷を持つイオンです(電子の損失による)。 この場合、陽イオンは、元素がその最も外側の電子層を空にし、希ガス構成を獲得することを可能にする電子の損失によって形成されます(s2p6)下位レベルから。 それらは最も一般的なタイプの陽イオンです。
例:
- 水素またはヒドロンカチオン(プロトンとも呼ばれる):H+
- ナトリウムカチオン:Na+
- 鉄(III)カチオンまたは第二鉄カチオン:Fe+3
- カルシウムカチオン:Ca+2
- 銅(II)または第二銅カチオン:Cu+2
多原子カチオン:定義と例
多原子カチオンは、2つ以上の原子によって形成されるカチオンです。 それらはまれであり、最も豊富なのは、複数を含むものである、いわゆるホモ多原子カチオンです。 同じ元素の原子、三水素イオンの場合、それはで最も豊富な分子の1つです 宇宙。 異なる元素の原子によって形成される多原子カチオンは一般的ではありませんが、 水素の存在であり、塩基性化合物がプロトンを捕捉したときに発生すると考えられています (H+).
例:
- アンモニウムカチオン:NH4+
- オキソニウムカチオン:HO3+
- ホスホニウムカチオン:PH3+
- 三水素カチオンまたはプロトン化水素分子:H3+
- 二水銀カチオン:Hg2+2
画像:惑星
に似た記事をもっと読みたい場合 マイナスイオンとプラスイオン:定義と例、次のカテゴリに入力することをお勧めします 原子.
参考文献
AlejandrinaGallegoPicó、RosaMªGarcinuñoMartínez、MªJoséMorcilloOrtega、MiguelÁngelVázquezSegura。 (2018) 基本化学. マドリッド:Uned



