周期表とは何ですか?
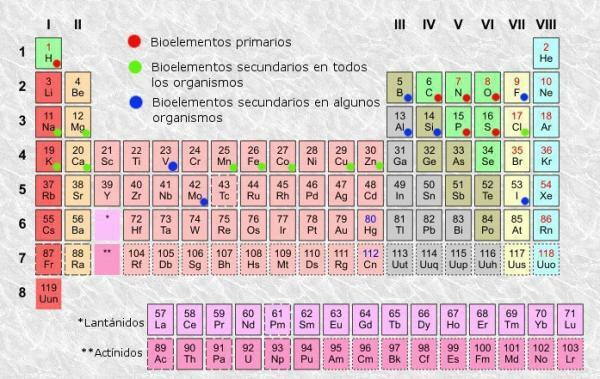
周期表は、1869年にロシアの化学者によって発明された原子元素の分類システムです。 ドミトリメンデレーエフとその後、彼の外観に達するまで他の化学者によって再編成され、更新されました 電流。 歴史を通して有用であることが証明されているツールであるにもかかわらず(それが使用され、更新され続けている理由です)、それは 学ぶことと理解することはとても退屈です、それが私たち全員が「テーブルは何のためにあるのか? 定期的? "。
知りたいなら の周期表は何ですか そして、その特性を理解することが重要である理由は、教師からのこのレッスンを読み続けてください。
インデックス
- 周期表の分類
- 周期表で元素の名前や記号を見つける
- 元素の原子量を知る
- 元素の原子番号を知る
- 元素の原子半径を予測する
- 2つの元素のイオン化エネルギーを比較します
- 化学元素の電気陰性度を見つける
- 2つの元素の電子親和力を比較します
周期表の分類。
他の表と同じように、 周期表 要素のうち、列(垂直)と行(水平)を区別できます。 周期表には、18の列またはグループと7つの行または期間があります。
さらに、通常、テーブルの各ボックス内に、少なくとも次の情報が表示されることを確認できます。
- 化学元素記号: 要素を識別するために使用される略語または記号。 それらは通常1つまたは2つの文字で構成され、最初の文字は常に大文字になります。
- 化学元素名: 上の略語に対応する化学元素の名前。 通常、シンボルの下にあります。
- 原子番号: その元素の各原子が持っている陽子の総数。 通常、アイテムボックスの左上(またはより完全なテーブルの右上)に表示されます。
- 原子質量: 原子の質量は通常、単一の原子内の陽子と中性子の総質量と見なすことができます。 最も単純な表では要素名の下に配置されていますが、他の表では要素ボックスの右上部分に表示される場合があります。
次のような他のタイプのより複雑で具体的な情報を含む周期表があります 酸化状態 (たとえば、化合物を処方するときに便利です)、イオン化エネルギー、電気陰性度などですが、基本的な周期表は通常 十分な情報を提供し、通常は平均的なユーザーにとって十分です。平均的なユーザーは、そこから以下に示すような情報を見つけることができます。

周期表で元素の名前や記号を調べてください。
時々私たちは知っています
化学元素記号 でも彼の名前はわかりません。 他の時には、私たちは知っています 化学元素名、ただし、その略語や記号ではありません。 実際、これがクラスであなたに起こったことは非常に簡単です。このような場合、複雑なものでなくても周期表を使用でき、不足しているデータをすばやく正確に調べることができます。
元素の原子量を知る。
時々私達は私達が扱っている化学元素を知っていますが私達はそれを知る必要があります 原子質量つまり、その元素の原子の重さです。
この情報は、たとえば、次のタスクを実行するときに役立ちます。
- 物質の特定の量を計算します。
- テストまたは実験で得られた結果を分析します。
- 質量のパーセンテージを計算します。
- 複雑な分子の正確なモル質量を理解します。
元素の原子番号を知っています。
原子番号は 元素の原子が持つ陽子の総数. 陽イオン以外の電気的に中性の原子(正に帯電し、通常の状態より1つの電子が少ない) または陰イオン(負に帯電し、通常の状態よりも電子が1つ多い)の場合、陽子の数は 電子。
電子や中性子の数は元素の種類を変えないので、陽子の数は、ある元素を別の元素と区別する際の決定要因です。

元素の原子半径を予測します。
原子半径は、互いにほとんど接触しない同じ元素の2つの原子の中心間の距離の半分です。 この場合、知っている 周期表上の化学元素の位置 おおよその原子半径を見つけたり、別の元素と比較したりするのに役立ちます。 このために、私たちはそれを知る必要があります 原子半径:
- 周期表の上から下に移動するにつれて増加します。
- 周期表を左から右に移動すると下降します。
このように、カルシウムはルビジウムよりも小さいですが、鉄よりも大きいです。
詳細については 原子半径はいくつですか 教師からのこの他のビデオレッスンで。
2つの元素のイオン化エネルギーを比較します。
ザ・ イオン化エネルギー それは 元素の原子から電子を取り除くのに必要なエネルギー. この場合、周期表の2つの元素の位置がわかれば、どちらの元素から電子を「奪う」のが簡単かがわかります。 以下のことのみを考慮する必要があります。
- イオン化エネルギーは、周期表を上下に移動するにつれて減少します。
- イオン化エネルギーは、周期表の左から右に移動するにつれて増加します。
ベリリウムと酸素の間では、酸素はより多くのイオン化エネルギーを持っています。 同じグループであるが次の期間にある酸素と硫黄を比較すると、酸素は周期表で高いため、イオン化エネルギーも高くなります。
化学元素の電気陰性度を調べます。
電気陰性度 それは 電子を引き付ける原子の能力. 実際には、これは化学結合を形成する能力に変換されます。 化学元素が化学結合を形成する大きな能力を持っているかどうかを知るには、周期表に続くパターン、つまり次のパターンを考慮するだけで済みます。
- 上下に動くと下降します。
- 左から右に移動すると増加します。
前の場合と同様に、酸素は最初の酸素よりも右側にあり、硫黄よりも高いため、ベリリウムや硫黄よりも電気陰性度が高くなります。

2つの元素の電子親和力を比較します。
ザ・ 電子親和力 彼は 中性原子が電子を引き付けるときに受けるエネルギーの変化 マイナスイオンになります。 この場合、電子親和力は前の場合ほど正確には変化しませんが、一般に、電子親和力は次のように言えます。
- 同じ時期に左から右に上昇します。
- 同じグループで、下から上に上昇します。
に似た記事をもっと読みたい場合 周期表とは何ですか?、次のカテゴリに入力することをお勧めします 原子.
参考文献
周期表の使い方について何か意見やコメントはありますか? コメント欄にお気軽にどうぞ! この記事は気に入りましたか? 以下に評価を残すこともできます!



