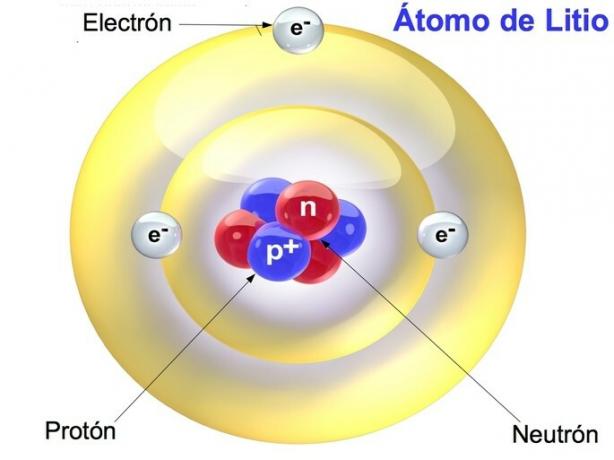
陽子、中性子、および電子
陽子、中性子、電子は、元素の最小部分である原子を構成する粒子です。 これらの粒子は、化学元素の特性と特性を決定します。
陽子と中性子は原子核に集中し、電子は地殻または原子の周辺に分布します。 原子は同じ数の電子と陽子を持っていますが、中性子の数は可変です。
次に、陽子、中性子、電子の比較表を示します。
| プロトン | 中性子 | 電子 | |
|---|---|---|---|
| 定義 | 正電荷の素粒子 | 亜原子中性荷電粒子 | 負に帯電した亜原子粒子 |
| 負荷 | ポジティブ +1 |
中性 0 |
負 -1 |
| シンボル | p+ | n0 | そして- |
| 原子内の位置 | 芯 | 芯 | 周辺軌道 |
| 質量(kg) | 1,673 x 10--27kg | 1,675 x 10--27kg | 9,109 x 10--31kg |
| 陽子と比較した質量(amu) | 1 | 1 | 0,0005 |
| 素粒子 | 3クォーク:2uと1d | 3クォーク:2dと1u | 1レプトン |
| 発見者(年) | そして。 ラザフォード(1911) | J。 チャドウィック(1931) | J.J.トムソン(1897) |
陽子とは何ですか?
陽子は、原子核にある正に帯電した粒子です。 元素の各原子には、その原子番号またはZを決定する固定数のプロトンがあります。 したがって、水素には陽子があり、Zは1に等しくなります。
陽子の質量は1.673x 10-27 kg、1原子質量単位またはamu(英語の頭字語)を表します 原子質量単位).
1911年、アーネスト・ラザフォードは、原子核が小さく正に帯電していることを発見しました。これが陽子の概念です。
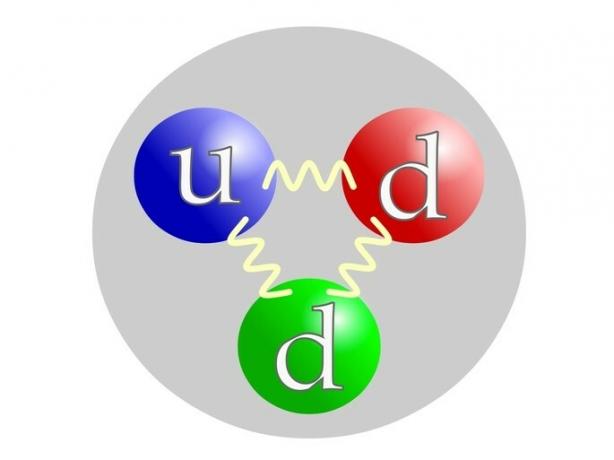
陽子はクォークまたはと呼ばれる素粒子で構成されています クォーク: 2クォークu(あたり アップ=上)および1 quartk d(by ダウン=ダウン)。

原子の陽子を計算する方法は?
原子内の陽子の数は、周期表の位置番号である原子番号から決定できます。
たとえば、Au金の原子番号は79です。これは、金の原子核に79個の陽子があることを意味します。
中性子とは何ですか?
中性子は、陽子とともに原子核に見られる粒子です。 それらは文字で示されます n そしてそれらは中性に帯電しています。 中性子を持たない唯一の元素は水素です。
中性子の質量は陽子の質量と非常に似ているため、陽子と中性子の質量の合計が元素の原子量を決定します。
原子番号が同じで、中性子の数が異なる原子は、同位体と呼ばれます。 たとえば、重水素は水素の同位体であり、原子核に中性子と陽子があります。
イギリスの物理学者ジェームズ・チャドウィックは、1931年にこの素粒子を発見しました。質量は陽子に近いが、中性の電荷を持っているため、中性子と呼ばれていました。
中性子は陽子のようにクォークによって構成されます:1クォークu(によって アップ=上)および2 quartk d(by ダウン=ダウン)。
原子の中性子を計算する方法は?
原子の質量と原子番号Zがわかれば、原子内の中性子の数を計算できます。 原子番号Zは陽子の数であり、原子量は原子が持つ陽子と中性子の合計であることはすでにわかっています。
たとえば、酸素の原子量は16で、Zは8です。 酸素中の陽子の数は、原子量からZを引いたものに等しくなります。
16-8 = 8中性子
電子とは何ですか?
電子は、原子核を取り巻く雲の中にある原子の粒子です。 陽子と中性子は原子核に集中しますが、電子は外側の層に分布します。
原子の最外殻にある電子は、ある原子から別の原子にジャンプする可能性があります。 これにより、原子に異なる電荷が与えられます。 たとえば、原子が電子を獲得した場合、その電荷は負になり、電子を失った場合、電荷は正になります。
これは、イオン、つまり1つまたは複数の電子を獲得または喪失する原子で発生することです。 たとえば、塩素には17個の電子がありますが、1個の電子を獲得してCl塩化物アニオンになることができます。-、18個の電子と負の電荷を持つ。
電子は1897年にJ.J.によって発見されました。 トムソン、「レーズンのプリン」の原子モデルと同じ。
電子はレプトンである素粒子で構成されています。
電子の質量は陽子や中性子の約2000分の1です。 陽子または中性子が10ポンドのボウリング球のサイズであるとすると、電子は小さな大理石のサイズになります。
したがって、原子質量を計算するとき、原子内の電子の質量は無視できます。
原子の電子を計算する方法は?
中性原子の電子の数は、その原子の陽子の数と同じです。 たとえば、Auゴールドには79個の陽子があるため、79個の電子があります。
あなたはまた見ることに興味があるかもしれません:
- 陽イオンと陰イオン
- 原子と分子.
参考文献
マイヤーズ、R.L。 (2005)物理学の基礎。 グリーンウッド。
ピーク、B.M。 (1989)電子、陽子、中性子の発見。 J.化学教育66:738。 DOI:10.1021 / ed066p738