そこにあるさまざまな種類の酵素-要約+ビデオ!

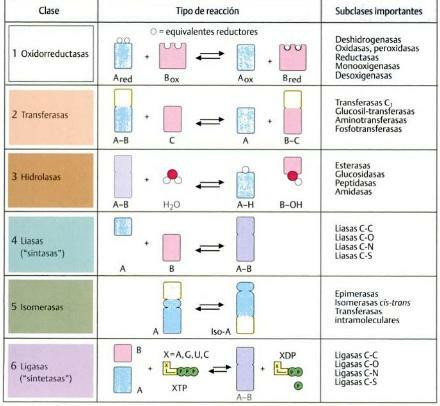
ザ・ 酵素 彼らは タンパク質の種類 私たちの生活と産業、医学などの両方で非常に重要です。 これは、その機能が化学触媒の機能であるためです。つまり、さまざまな反応が発生しやすくなります。 それらが促進する反応に応じて、酵素は6つの主要なグループに分類できます。
教師からのこのレッスンでは、 私たちが見つけることができる酵素の種類. 酵素についてもっと知りたい場合は、読み続けてください!
インデックス
- I:オキシドレダクターゼ酵素
- II:トランスフェラーゼ酵素
- III:加水分解酵素
- IV:リアーゼ酵素
- V:イソメラーゼ酵素
- VI:リガーゼ酵素
I:オキシドレダクターゼ酵素。
ザ・ オキシドレダクターゼ酵素 それらは私達が学ぼうとしている酵素のタイプの1つです。 それらは、レドックスまたはレドックス反応を触媒または促進することを担当するものです。 つまり、これら 酵素 彼らは世話をします 水素(H)または電子(e-)の移動 ある基板から別の基板へ。
オキシドレダクターゼ酵素のいくつかの例は、コハク酸デヒドロゲナーゼ、ペルオキシダーゼ、またはチトクロームcオキシダーゼである。 酸化還元酵素には 生物にとって非常に重要、解糖の過程でとりわけ介入するので。 解糖反応は、糖分子からエネルギーを抽出する反応であり、生物の間でエネルギーを得る非常に普及した方法です。
II:トランスフェラーゼ酵素。
トランスフェラーゼ型酵素 化学基の移動を触媒または促進する (水素以外)ある基板から別の基板へ。 通常、これらは、1つの分子または分子のグループを別の特定の官能基に移動させることを担当する酵素です。
このように、トランスフェラーゼは 大きくて複雑な生体分子の形成、その速度のため、または反応に必要な他の基の濃度などの他の条件のために、生命の維持と互換性のある条件下では不可能でした。
トランスフェラーゼ酵素の種類には多くの例がありますが、哺乳類の場合に特に重要なのは酢酸CoAトランスフェラーゼです。 クレブス回路の適切な機能における重要な酵素、私たちに多くのエネルギーを素早く与え、 効率的。 酵素トランスフェラーゼの他の例は、グルコキナーゼ、ヘキソキナーゼ、キナーゼ、ホスホトランスフェラーゼ、またはトランスミナーゼである。
画像:Googleサイト
III:加水分解酵素。
ザ・ 酵素 加水分解酵素の種類はそれらです
リンクを解除する責任があります。 加水分解酵素は、分子間の結合を切断するために、加水分解と呼ばれる反応を実行します。つまり、水分子を使用して化学結合の切断を促進します。 加水分解は通常、より大きな化学的に複雑な分子から2つのより小さくより単純な分子の生成をもたらします。加水分解酵素の種類の中で、それらが作用して分離する分子に応じて、さまざまなサブグループを見つけることができます。 たとえば、脂質に作用するリパーゼがあります。 アミノ酸に影響を与えるペプチダーゼ; ヌクレオチドに作用するヌクレオチダーゼ; エステルを加水分解するエステラーゼ。
加水分解酵素は特に 消化中に重要です。 乳糖を構成する糖分子を分離する酵素であるラクターゼの欠如または少量は、乳糖に対する不耐症またはアレルギーを引き起こします。
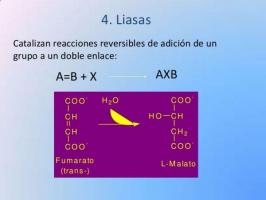
IV:リアーゼ酵素。
リアーゼの種類について話すさまざまな種類の酵素は、前のものと同様に、 リンクを解除する責任があります. リアーゼと加水分解酵素の違いは非常に単純です:リアーゼ 彼らは水分子を必要としません 加水分解酵素が行う間、それらの機能を実行します。 また、適切な条件下では、リアーゼはそれらを破壊するのではなく、逆反応して結合を形成することができます。
リンク解除機能は生き残るために非常に重要です。 すべての生物の中で最も現在の例の1つは、ATP分子の場合のように、化学結合に蓄積されたエネルギーの使用です。 ATPは、エネルギーが非常に豊富ないくつかの結合を持つ分子であり、制御された方法で分離されると、それが生成される生物が使用できるエネルギーを提供します。
リアーゼ酵素の別の例は、シンターゼ、デヒドラターゼ、アルドラーゼ、アセテートデカルボキシラーゼなどである。 リアーゼは、臨床検査で病気を診断するためによく使用されます:レベルが高すぎる または特定の酵素のレベルが低いと、特定の臓器の障害や正常に機能しない生化学的プロセスについての手がかりが得られます。

画像:Slideshare
V:イソメラーゼ酵素。
イソメラーゼは、その機能が 同じ分子の形を変えます。 つまり、この場合、分子を構成する原子は同じであり、分子の一部を削除または追加する必要はありませんが、別の方法で再配置されて別の分子を形成します。
これらの分子は、組成は同じですが、原子の3次元配置が異なり、次のように知られています。 異性体. 異性体は、同じ分子の順列または構造変異です。 A、B、Cの3つの異なるブロックで構成されるタンパク質を想像してみましょう。 イソメラーゼが作用すると、A-B-C分子の異性体となる別の分子C-B-Aが生成される可能性があります。
イソメラーゼ酵素の例は、ホスホトリオースイソメラーゼ、ホスホグルコースイソメラーゼ、シス-トランスイソメラーゼ、エピメラーゼ、またはムターゼである。
VI:リガーゼ酵素。
最後のタイプの酵素はリガーゼのタイプです。 リガーゼは、 分子を結合または結合する 共有結合による。 その有用性は、例えば、DNAのコピーと修復において非常に大きいです。 通常の方法では、DNAは細胞の機能に深刻な損傷を引き起こす可能性のある破壊を受ける可能性があります。
DNAリガーゼ、責任があるリガーゼの一種 DNA分子を結合する; この酵素は 休憩を修復する これらの文字列の間に発生しました。 しかし、これだけではありません。本質的に、リガーゼには多くの異なるタイプとサブタイプがあります。カルボキシラーゼ、ピルビン酸カルボキシラーゼ、シンテターゼ、DNAシンテターゼなどです。

に似た記事をもっと読みたい場合 酵素の種類、次のカテゴリに入力することをお勧めします 生物学.
参考文献
- バスク大学(s.f)酵素の分類。 から回復: http://www.ehu.eus/biomoleculas/enzimas/enz13.htm
- Jaeger KE、Eggert T(2004年8月)。 「定向進化によって最適化されたエナンチオ選択的生体触媒作用」。 バイオテクノロジーにおける現在の意見。 15 (4): 305–13. 土井:10.1016 /j.copbio.2004.06.007。 PMID15358000。
- バーグ、J。 M.、Tymoczko、J。 L.、Stryer、L。(2002)。 酵素:基本的な概念と速度論。