განსხვავება ძლიერ და სუსტ მჟავებსა და ბაზებს შორის (მაგალითებით)
ქიმიაში მჟავებისა და ბაზების კლასიფიკაცია დამოკიდებულია ამ ნივთიერებების იონიზაციის ძალაზე წყალმცენარეში. ა) დიახ:
- ა მჟავა და ფუძე ძლიერია როდესაც ისინი მთლიანად იონიზირდებიან, ანუ იონიზაციის პროცესში ისინი მთლიანად გადაიქცევიან კატიონებად ან დადებით იონებად და ანიონებად ან უარყოფით იონებად.
- Მეორეს მხრივ, მჟავა და ფუძე სუსტია როდესაც ისინი ნაწილობრივ იონიზირდებიან წყალში, ანუ ხსნარში იქნება კატიონების, ანიონების სხვა და სხვა განუყოფელი მოლეკულების სხვა წილი.
| ძლიერი მჟავები და ბაზები | სუსტი მჟავები და ბაზები | |
|---|---|---|
| განმარტება | ნივთიერებები, რომლებიც მთლიანად იონიზდება ხსნარში. | ნივთიერებები, რომლებიც ნაწილობრივ იონიზდება ხსნარში. |
| იონიზაცია | დასრულებულია | ნაწილობრივი |
| ელემენტები წყალხსნარში | კატიონები და ანიონები იმავე კონცენტრაციაში. | კატიონები, ანიონები და მოლეკულები სხვადასხვა პროპორციით. |
| იონიზაციის მუდმივი | ამაღლებული | პატარა |
| მაგალითები |
|
|
ძლიერი მჟავები და ბაზები
ა მჟავა ან ფუძე ძლიერია, როდესაც წყალხსნარში ისინი მთლიანად განიცდიანსხვა სიტყვებით რომ ვთქვათ, იონიზაციის პროცესი დასრულებულია და ხსნარი შეიცავს ანიონებისა და კათიონების იგივე კონცენტრაციას.
როგორ იონიზებთ მჟავას და ძლიერ ფუძეს?
ძლიერი მჟავა, მაგალითად, მარილმჟავას HCl, იონიზდება შემდეგი გზით:
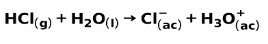
ძლიერი ფუძე, მაგალითად, ნატრიუმის ჰიდროქსიდი NaOH, იონიზდება შემდეგი გზით:
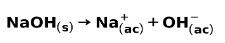
ძლიერი მჟავების მაგალითები და მათი ფორმულები
| ძლიერი მჟავები | ფორმულა |
|---|---|
| Მარილმჟავა | HCl |
| Გოგირდის მჟავა | ჰ2SW4 |
| აზოტის მჟავა | HNO3 |
| ჰიდრობრომმჟავა | HBr |
| პერქლორინის მჟავა | HClO4 |
| ქრომის მჟავა | ჰ2CrO4 |
| ტეტრაფლურობორის მჟავა | HBF4 |
ძლიერი ბაზების მაგალითები და მათი ფორმულები
| ძლიერი ბაზა | ფორმულა |
|---|---|
| ნატრიუმის ჰიდროქსიდი | NaOH |
| ლითიუმის ჰიდროქსიდი | LiOH |
| Კალიუმის ჰიდროქსიდი | KOH |
| რუბიდიუმის ჰიდროქსიდი | RbOH |
| ცეზიუმის ჰიდროქსიდი | CsOH |
| კალციუმის ჰიდროქსიდი | Ca (OH)2 |
| ბარიუმის ჰიდროქსიდი | ბა (ოჰ)2 |
| სტრონციუმის ჰიდროქსიდი | Sr (OH)2 |
| ალუმინის ჰიდროქსიდი | ალ (ოჰ)3 |
შეიძლება დაგაინტერესოთ მეტის ნახვა მჟავებისა და ბაზების მაგალითები.
სუსტი მჟავები და ბაზები
ა მჟავა ან ფუძე სუსტია, როდესაც ნაწილობრივ იონიზდება წყალხსნარში, ანუ ხსნარში არის იონები და არაიონიზირებული მოლეკულები.
როგორ იონიზებთ მჟავას და სუსტ ფუძეს?
სუსტი მჟავა, მაგალითად, ძმარმჟავა CH3COOH, იონიზირებულია შემდეგი გზით:
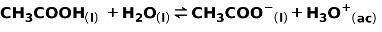
ამ რეაქციის წონასწორობა გამოხატულია ორი ისრით, საწინააღმდეგო მიმართულებით.
როდესაც სუსტი მჟავა დისოცირდება ან იონიზდება, წონასწორობა დამყარდა ხსნარში არსებულ სახეობებს შორის; ეს შეიძლება გამოხატავდეს ა იონიზაციის მუდმივიმჟავე:
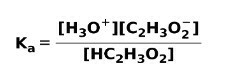
იონიზაციის მუდმივა სხვა არაფერია, თუ არა პროდუქციის კონცენტრაციის გამრავლების და რეაქტიული ნივთიერებების კონცენტრაციის გამრავლების თანაფარდობა.
სუსტი ფუძე, მაგალითად NH ამიაკი3, იონიზირებულია შემდეგი გზით:
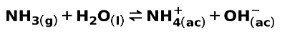
სუსტი ფუძის დისოცირების ან იონიზებისას, წონასწორობა დამყარდა ხსნარში არსებულ სახეობებს შორის; ეს შეიძლება გამოხატავდეს ა ბაზის იონიზაციის მუდმივა:
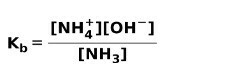
შეიძლება დაგაინტერესოთ იცოდეთ განსხვავება მჟავები და ბაზები.
სუსტი მჟავების მაგალითები მათი ფორმულით და მჟავას იონიზაციის მუდმივი Kრომ
| სუსტი მჟავა | ფორმულა | იონიზაციის მუდმივი |
|---|---|---|
| ფორმჟავა | ჰ2კომპანია2 | 1,77 x 10-4 |
| ძმარმჟავა | ჰ3CCOH | 1,75 x 10-5 |
| ჰიდროციანის მჟავა | HOCN | 3,30 x 10-4 |
| წყალბადის ციანიდი | HCN | 6,20 x 10-10 |
| ჰიპოქლორინის მჟავა | HOCl | 3.50 x 10-8 |
| აზოტის მჟავა | HNO2 | 4,00 x 10-4 |
| რძემჟავა | HC3ჰ5ან3 | 1,40 x 10-4 |
| ნახშირმჟავა | ჰ2კომპანია3 |
4,30 x 10-7 5,60 x 10-11 |
| Ბორის მჟავა | ჰ3BO3 |
5,80 x 10-10 1,80 x 10-13 3.00 x 10-14 |
სუსტი ფუძეების მაგალითები მათი ფორმულით და ძირითადი იონიზაციის მუდმივით Kბ
| სუსტი ბაზა | ფორმულა | იონიზაციის მუდმივი |
|---|---|---|
| ამიაკი | NH3 | 1,75 x 10-5 |
| მეთილამინი | CH3NH2 | 4,38 x 10-4 |
| ეთილამინი | გ2ჰ5NH2 | 5,60 x 10-4 |
| ანილინი | გ6ჰ5NH2 | 3.80 x 10-10 |
| პირიდინი | გ5ჰ5ნ | 1,70 x 10-9 |
| ბენზილამინი | გ7ჰ9ნ | 2.20 x 10-5 |
| ნატრიუმის ბიკარბონატი | NaHCO | 2.00 x 10-4 |
შეიძლება დაგაინტერესოთ ამის შესახებ მეტის ცოდნა მჟავებისა და ბაზების მახასიათებლები