მჟავების და ბაზების მახასიათებლები: ძირითადი განსხვავებები
მჟავებისა და ბაზების მახასიათებლებია ყველა ის თვისება და თვისება, რომლითაც შეგვიძლია განვასხვავოთ მჟავა და ფუძე.
არჰენიუსის თეორიის თანახმად, ა მჟავა არის ნივთიერება, რომელიც გამოყოფს პროტონის H- ს+ წყალში გახსნისას და ა ბაზა არის ნებისმიერი ნივთიერება, რომელიც გამოყოფს ჰიდროქსილის იონებს OH- როდესაც წყალხსნარშია.
| მჟავები | ბაზები | |
|---|---|---|
| იონის ფორმირება | აწმყო | აწმყო |
| ნეიტრალიზაციის რეაქცია | როდესაც ის რეაგირებს ფუძესთან. | როდესაც ის რეაგირებს მჟავასთან. |
| წყალში ხსნადობა | ხსნადი | ნაწილობრივ ხსნადი. კალციუმი, ბარიუმი და ალუმინის ჰიდროქსიდები ცუდად იხსნება. |
| ელექტროგამტარობა | აწმყო | აწმყო |
| საკითხის მდგომარეობა | მყარი, თხევადი ან გაზური | მყარი, თხევადი ან გაზური |
| რეაქცია ლაკმუსის ქაღალდით | წითელი შეღებვა | ლურჯი შეღებვა |
| PH მნიშვნელობა | 7 წლამდე | 7-ზე მეტი |
| შერწყმული კოლეგა | სუსტი მჟავა ქმნის კონიუგირებულ ფუძეს. | სუსტი ფუძე ქმნის კონიუგირებულ მჟავას. |
| კოროზიული ეფექტი | ძლიერი მჟავები | ძლიერი ბაზები |
მჟავების მახასიათებლები
მჟავებს აქვთ რამდენიმე მახასიათებელი, რომლითაც შეიძლება მათი იდენტიფიცირება.
მჟავებისგან იონების წარმოქმნის უნარი
მჟავე ნივთიერებების მთავარი მახასიათებელია ის, რომ ისინი შეიძლება იონიზირდნენ, ანუ დაკარგონ ან მოიპოვონ ელექტრონები.
მარილმჟავა HCl, ძლიერი მჟავა, იონიზდება და წარმოქმნის ქლორიდ ანიონს Cl- და პროტონი H+.
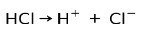
ნეიტრალიზაციის რეაქცია
მჟავა რეაგირებს ბაზასთან და ქმნის მარილს და წყალს. ეს რეაქცია ცნობილია, როგორც ნეიტრალიზაციის რეაქცია. მაგალითად, HCl რეაგირებს NaOH– სთან და ქმნის ნატრიუმის ქლორიდს NaCl (სამზარეულოს მარილს) და წყალს:
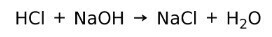
მჟავების წყალში ხსნადობა
მჟავები ზოგადად წყალში იხსნება. მაგალითად, მარილმჟავას ან მურიის მჟავას ზომიერად ხსნადი წყალში, 82 გ HCl შეიძლება დაიშალა 100 მლ წყალში 0ºC ტემპერატურაზე. გოგირდმჟავას შემთხვევაში H2SW4, წყალთან ნარევი წარმოქმნის სითბოს, ამიტომ ყოველთვის სასურველია წყალში მჟავას დამატება, აფეთქებების თავიდან ასაცილებლად.
მჟავა ძალა
როგორ ხდება მჟავების დისოციაცია, განსაზღვრავს ისინი ძლიერი თუ სუსტი. მჟავის სიძლიერეს იძლევა მისი დისოციაციის მუდმივი.
აზოტის მჟავა HNO3 ეს არის ძლიერი მჟავა რადგან წყალხსნარში იგი მთლიანად იონიზდება პროტონებად და ნიტრატის იონებად:

ეს ნიშნავს, რომ როდესაც HNO- ს დავამატებთ3 წყალში, წყლის გაანალიზებისას აღმოვაჩენთ მხოლოდ H- ს+ და ნიტრატის იონები და პრაქტიკულად არავითარი HNO3.
ამის ნაცვლად, ძმარში აღმოჩენილი ძმარმჟავა არის a სუსტი მჟავა, რადგან მისი მხოლოდ ნაწილია დისოცირებული:
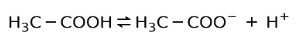
ამიტომ ის ისრებით არის წარმოდგენილი ორი მიმართულებით, ეს ნიშნავს, რომ წყალხსნარში გვექნება ძმარმჟავა, H+ და აცეტა ანიონი (H3C-COO-).
მჟავების ნივთიერებების მდგომარეობა
მჟავები გვხვდება თხევად, მყარ ან გაზურ მდგომარეობაში. მაგალითად, მარილმჟავას HCl არის თხევადი, გოგირდწყალბადის HS არის გაზი და ოქსალინის მჟავა მყარია.
რეაქცია მჟავებისგან ლაკმუსის ქაღალდთან

როდესაც ლაკმუსის ქაღალდის ზოლს ვდებთ მჟავე ნივთიერებაში, ლაკმუსის ქაღალდი წითლდება.
მჟავების იდენტიფიკაცია მათი pH– ით
PH არის H- ის ოდენობის საზომი+ ხსნარში იმყოფება. ამრიგად, pH 0-სა და 7-ს შორის, ჩვენ მჟავას თანდასწრებით ვართ. მაგალითად, ძმარს აქვს pH ტოლი 2-ის, გოგირდმჟავას pH მანქანის ბატარეებში უდრის 1-ს.
მჟავების ელექტროგამტარობა
მას შემდეგ, რაც მჟავებს შეუძლიათ დისოცირება და წარმოქმნან ელექტრონულად დამუხტული იონები, მჟავე ხსნარებს შეუძლიათ ელექტროენერგიის გატარება. მაგალითად, მანქანის ელემენტების შიგნით გოგირდის მჟავა, რომელიც ძლიერი მჟავაა, გამოიყენება როგორც ელექტროენერგიის გამტარებელი.
ძლიერი მჟავების კოროზიული ეფექტი
ძლიერი მჟავებს აქვთ კოროზიული მოქმედება, მათ შეუძლიათ დაწვან ორგანული ქსოვილები, ამიტომ მათი დამუშავება ძალიან ფრთხილად უნდა მოხდეს.
სუსტი მჟავები ქმნიან კონიუგირებულ კოლეგას
როდესაც იხსნება, სუსტი მჟავები ქმნიან მას, რაც კონიუგირებული წყვილია, ანუ სუსტი მჟავა ქმნის კონიუგირებულ ფუძეს.
Მაგალითად:

ამ შემთხვევაში, ფორმალური ან მეთოანის მჟავა (HCOOH), როდესაც ხდება დისოციაცია, ქმნის კონიუგირებულ ბაზის იონის ფორმატს.
ეს შეიძლება დაგაინტერესოთ:
- ძლიერი და სუსტი მჟავები და ბაზები.
- მჟავებისა და ბაზების მაგალითები.
ბაზების მახასიათებლები
შემდეგ წარმოგიდგენთ ბაზების ან ტუტე ხსნარების თვისებებს, რომლებიც ახასიათებს მათ.
ბაზის იონიზაციის მოცულობა
ძირითადი ან ტუტე ნივთიერებები ახასიათებს იონების წარმოქმნას წყალში გახსნისას:

ამ შემთხვევაში, ნატრიუმის ჰიდროქსიდი NaOH იონიზდება და წარმოქმნის ჰიდროქსიდ ანიონს OH- და ნატრიუმის კატიონის Na+.
ფუძე რეაგირებს მჟავასთან და ქმნის მარილს
ბაზა რეაგირებს მჟავასთან ნეიტრალიზაციის რეაქციაში წყლისა და მარილის წარმოქმნით, მაგალითად:

ამ შემთხვევაში, ალუმინის ჰიდროქსიდი Al (OH)3, ფუძე, რეაგირებს HCl და ქმნის ალუმინის ქლორიდის მარილს AlCl3 და წყალი. ალუმინის ჰიდროქსიდი გამოიყენება როგორც ანტაციდი კუჭის რეფლუქსის მოსახსნელად კუჭის მიერ წარმოქმნილი მჟავის განეიტრალებით.
საფუძვლად უდევს წყალში ხსნადობას
ზოგიერთი ფუძე წყალში ხსნადია. დედამიწის ტუტე ჰიდროქსიდები, როგორიცაა კალციუმის ჰიდროქსიდი და ბარიუმის ჰიდროქსიდი, წყალში ცუდად იხსნება. მაგალითად, ნატრიუმის ჰიდროქსიდი ან კასტიკური სოდა შეიძლება დაიშალა 109 გრ 100 მლ წყალში 20ºC ტემპერატურაზე. მაგნიუმის ჰიდროქსიდი ან მაგნიუმის რძე მგ (OH)2 იგი პრაქტიკულად არ იხსნება წყალში.
ბაზის ძალა
ბაზის იონიზაციის ხარისხის მიხედვით, ეს შეიძლება იყოს ძლიერი და სუსტი. მაგალითად, ლითიუმის ჰიდროქსიდი არის a ძლიერი ბაზა რადგან წყალხსნარში იგი მთლიანად იონიზდება ჰიდროქსიდის იონებად OH და ლითიუმ Li კატიონებად+:
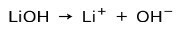
მეორეს მხრივ, ამიაკი NH3 არის სუსტი ბაზა რადგან წყალთან შეხებისას ყველა ამიაკი არ გამოყოფს:
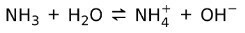
ბაზების საკითხის მდგომარეობა
ბაზების პოვნა შესაძლებელია მყარ, თხევად და გაზურ მდგომარეობებში. მაგალითად, ნატრიუმის სუფთა ჰიდროქსიდი მყარია, ამიაკი არის გაზი.
რეაქცია ბაზების ლაკმუსის ქაღალდთან
როდესაც ლაკმუსის ქაღალდის ზოლს ტუტე ნივთიერებაში ვდებთ, ქაღალდი ლურჯდება.
ბაზების იდენტიფიკაცია მათი pH– ით
ფუძეებს ახასიათებთ pH– ის მქონე 7 – დან 14 – მდე.
 ბაზების ელექტროგამტარობა
ბაზების ელექტროგამტარობა
მათი მაიონიზაციის შესაძლებლობებიდან გამომდინარე, ელექტროენერგიის კარგი გამტარებია. მაგალითად, ტუტე ბატარეებში, კალიუმის ჰიდროქსიდი KOH გამოიყენება როგორც ელექტრული გამტარი.
ბაზების კოროზიული ეფექტი
ძლიერმა ფუძემ შეიძლება დააზიანოს ორგანული ქსოვილები. მაგალითად, სამზარეულოს ღუმელის საწმენდები ზოგადად ძლიერი საფუძველია და ყოველთვის რეკომენდირებულია მათი განსაკუთრებული სიფრთხილით მოქცევა, ხელთათმანების ტარება და თვალის დაცვა.
სუსტი ბაზები ქმნიან კონიუგირებულ კოლეგას
გახსნისას სუსტი ფუძეები ქმნიან კონიუგირებულ კოლეგას, ანუ სუსტი ფუძე ქმნის კონიუგირებულ მჟავას.
მაგალითად, ტრის- (ჰიდროქსიმეთილ) ამინ მეთანი (OHCH)2)3CNH2 არის სუსტი ფუძე, რომლის კონიუგირებული მჟავაა (OHCH)2)3CNH3+:
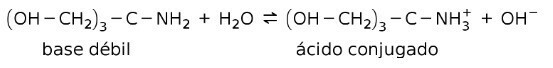
ეს არის ბუფერული ნივთიერებების მოქმედების საფუძველი ბუფერული, რომლებიც არის ნივთიერებები, რომლებიც გამოიყენება ხსნარების pH მუდმივად შესანარჩუნებლად.
თქვენ შეიძლება დაინტერესდეთ, თუ რა განსხვავებაა შემდეგში:
- მჟავები და ბაზები.
- კათიონები და ანიონები



