10가지 유형의 화학 결합(예시와 함께 설명)
화학 결합은 원자를 함께 묶는 힘 분자를 형성합니다. 원자 사이에는 세 가지 유형의 결합이 있습니다.
- 금속 본드.
- 이온 결합.
- 공유 결합: 비극성, 극성, 단순, 이중, 삼중, 날짜.
이러한 결합 덕분에 자연에 존재하는 모든 화합물이 형성됩니다. 다음과 같이 분자간 결합으로 알려진 분자를 함께 유지하는 힘도 있습니다.
- 수소 결합 또는 결합.
- 쌍극자-쌍극자 힘.
다음으로 이러한 각 링크에 대해 설명합니다.
| 화학 결합의 종류 | 특성 | 예 | |
|---|---|---|---|
| 금속 | 금속 이온은 움직이는 전자의 바다에 떠 있습니다. | 금속 원소: 나트륨, 바륨, 은, 철, 구리. | |
| 이온 | 한 원자에서 다른 원자로 전자의 이동. | 염화나트륨+클- | |
| 공유 | 비극성 | 두 원자 사이에서 전자를 동등하게 공유합니다. | 분자 수소 H-H 또는 H2 |
| 극선 | 두 원자 사이에 고르지 않게 전자를 공유합니다. | 물 분자 H2또는 | |
| 단순한 | 한 쌍의 전자를 공유합니다. | 염소 분자 Cl2 Cl-Cl | |
| 더블 | 두 쌍의 전자를 공유합니다. | 산소 분자 O2 오 = 오 | |
| 삼루타 | 세 쌍의 전자를 공유하십시오. | 질소 분자 N≣N 또는 N2 | |
| 여격 | 원자 중 하나만 전자를 공유합니다. | 암모니아-삼불화붕소 화합물에서 질소와 붕소 사이의 결합. | |
| 분자간 힘 | 수소 다리 | 한 분자의 수소는 다른 분자의 전기 음성 원자에 끌립니다. | 한 물 분자의 수소와 다른 물 분자의 산소 사이에 수소 결합이 있습니다. |
| 쌍극자 쌍극자 | 두 개의 전기 극을 가진 분자는 다른 분자의 반대 극을 끌어 당깁니다. | 메탄 H 분자 간의 상호 작용2C = 오 |
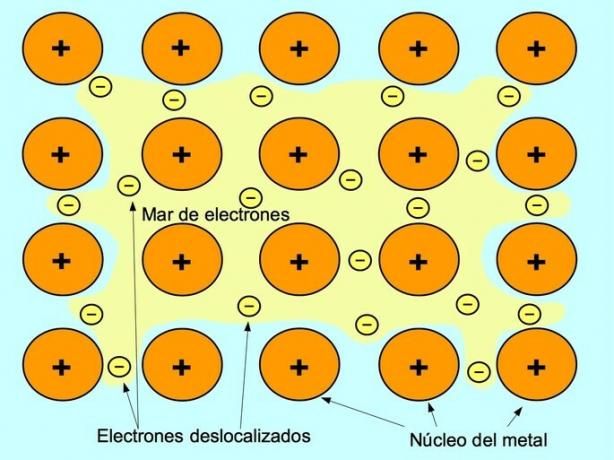
금속 결합
금속 결합은 금속 원소의 양이온과 이온 사이를 자유롭게 움직이는 음이온 사이의 인력입니다. 금속 원자는 단단히 포장되어 전자가 원자 격자 내에서 이동할 수 있습니다.
금속에서 원자가 전자는 원래 원자에서 방출되어 전체 금속 구조 주위에 떠 있는 전자의 "바다"를 형성합니다. 이로 인해 금속 원자가 함께 묶이는 양전하를 띤 금속 이온으로 변형됩니다.
나트륨 Na, 바륨 Ba, 칼슘 Ca, 마그네슘 Mg, 금 Au, 은 Ag 및 알루미늄 Al과 같은 금속 원소 사이에 금속 결합이 설정됩니다.
이온 결합
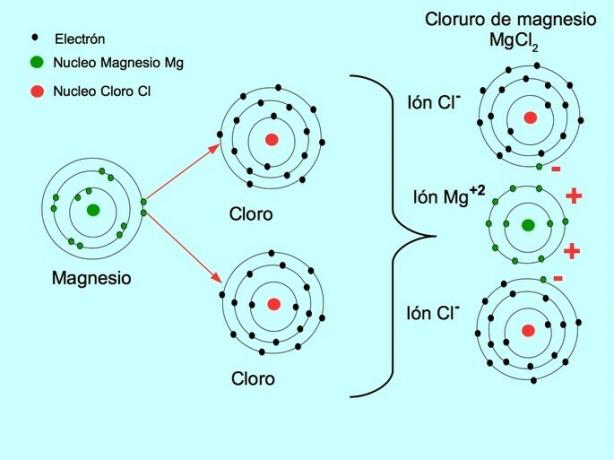
이온 결합은 나트륨이나 마그네슘과 같은 금속 원소를 염소나 황과 같은 비금속 원소와 결합시키는 힘입니다. 금속은 전자를 잃고 양이온이라는 금속 이온으로 변합니다. 양이온. 이 전자는 비금속 원소로 전달되어 음전하를 띤 이온으로 변환됩니다. 음이온.
양이온과 음이온은 결합하여 서로 다른 전하를 가진 이온 사이의 정전기 인력에 의해 유지되는 3차원 네트워크를 형성합니다. 이러한 힘은 이온성 화합물을 형성합니다.
지각은 주로 이온성 화합물로 이루어져 있습니다. 대부분의 암석, 광물 및 보석은 이온성 화합물입니다. 예:
- 염화나트륨 NaCl: 금속원소는 비금속원소인 염소에 전자를 전달하는 나트륨이다.
- 염화마그네슘 MgCl2: 마그네슘 Mg는 아래 그림과 같이 두 개의 염소 원자에 두 개의 전자를 제공합니다.
또한보십시오 양이온과 음이온의 차이점.
공유 결합
공유 결합은 두 개의 비금속 원자가 전자를 공유할 때 형성됩니다. 이 결합은 원자의 전자에 대한 친화력과 공유되는 전자의 양에 따라 여러 유형이 될 수 있습니다.
비극성 공유 결합
비극성 공유 결합은 전자가 동등하게 공유되는 두 원자 사이에 형성되는 결합입니다. 이 결합은 일반적으로 대칭 분자, 즉 수소 분자 H와 같은 두 개의 동일한 원자로 구성된 분자에서 발생합니다.2 그리고 산소 분자 O2.

극성 공유 결합
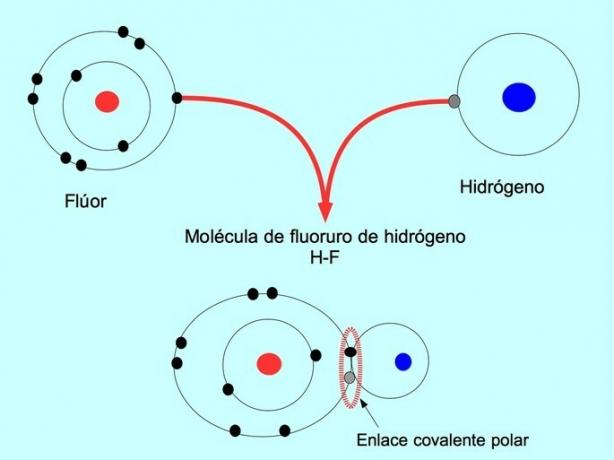
극성 공유 결합은 두 원자가 전자를 공유하지만 그 중 하나가 전자에 대해 더 큰 인력을 가질 때 형성됩니다. 이것은 분자가 더 많은 전자와 더 많은 음의 "극"을 가지도록 만들고 반대 극은 더 긍정적입니다.
전자의 이러한 분포 또는 불균형을 가진 분자를 극성이라고 합니다. 예를 들어, 불화수소 HF에는 수소와 불소 사이에 공유 결합이 있고, 그러나 불소는 전기 음성도가 더 높기 때문에 전자를 더 강하게 끌어당깁니다. 공유.
단순 공유 결합
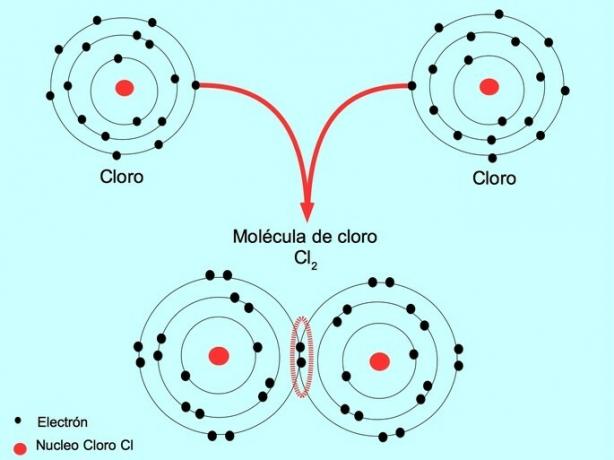
두 원자가 각각 하나씩 두 개의 전자를 공유할 때 형성된 공유 결합을 단일 공유 결합이라고 합니다.
예를 들어, 염소는 8개의 전자로 채워질 수 있는 외부 껍질에 7개의 원자가 전자를 가진 원자입니다. 염소는 다른 염소와 결합하여 염소 분자 Cl을 형성할 수 있습니다.2 염소 단독보다 훨씬 안정적입니다.
이중 공유 결합
이중 공유 결합은 4개의 전자(2쌍)의 전자가 두 원자 사이에 공유되는 결합입니다. 예를 들어, 산소의 마지막 껍질에는 6개의 전자가 있습니다. 2개의 산소가 결합되면 4개의 전자가 2개 사이에 공유되어 각각 마지막 껍질에 8개의 전자를 갖게 됩니다.
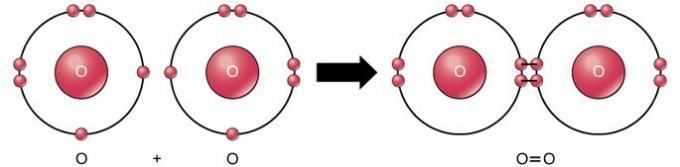
삼중 공유 결합
삼중 공유 결합은 6개의 전자(또는 3개의 쌍)가 두 원자 사이에 공유될 때 형성됩니다. 예를 들어, 시안화수소 분자 HCN에서 아래 그림과 같이 탄소와 질소 사이에 삼중 결합이 형성됩니다.
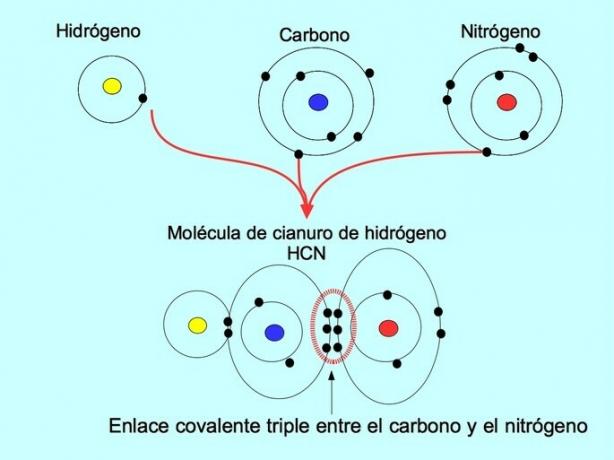
좌표 또는 날짜 공유 결합
배위 또는 결합 공유 결합은 결합의 원자 중 하나만 전자 쌍을 제공할 때 형성되는 결합입니다. 예를 들어 암모니아 NH가 반응할 때3 삼불화붕소 BF 포함3, 질소는 공유할 수 있는 전자가 없는 붕소에 직접 두 개의 전자와 결합합니다. 이러한 방식으로 질소와 붕소는 모두 원자가 껍질에 8개의 전자를 남깁니다.
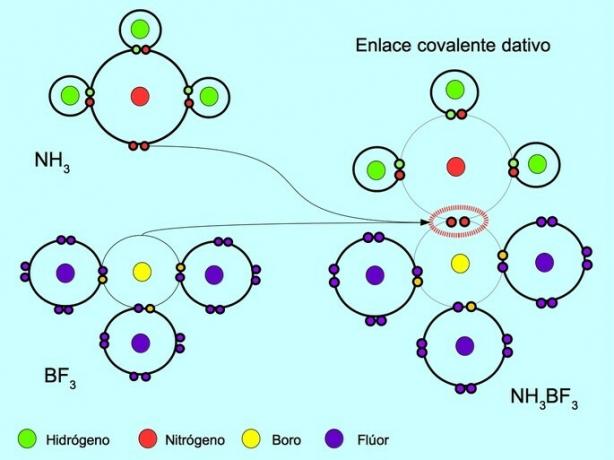
또한보십시오 유기 및 무기 화합물.
분자간 연결
분자는 힘을 통해 결합하여 액체 또는 고체 상태의 물질을 형성할 수 있습니다.
쌍극자-쌍극자 결합 또는 힘
음극이 양극에 끌릴 때 극성 분자 사이에 약한 분자간 결합이 형성되고 그 반대의 경우도 마찬가지입니다. 예를 들어, 메탄올 H2C = O는 산소에 부분적으로 음전하를 띠고 수소에 부분적으로 양전하를 띠는 극성 분자입니다. 한 메탄 분자의 긍정적인 면은 다른 메탄 분자의 부정적인 면을 끌어당깁니다.
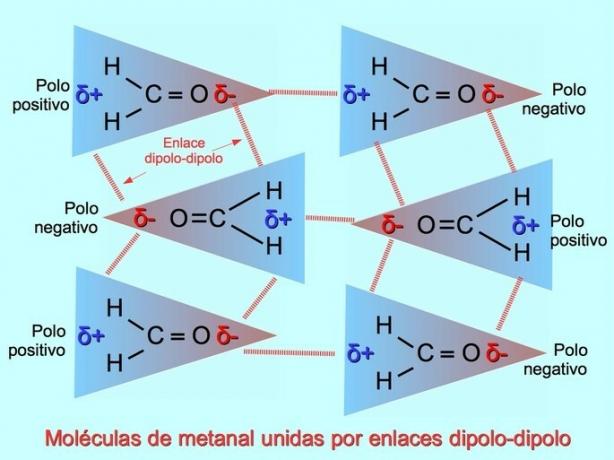
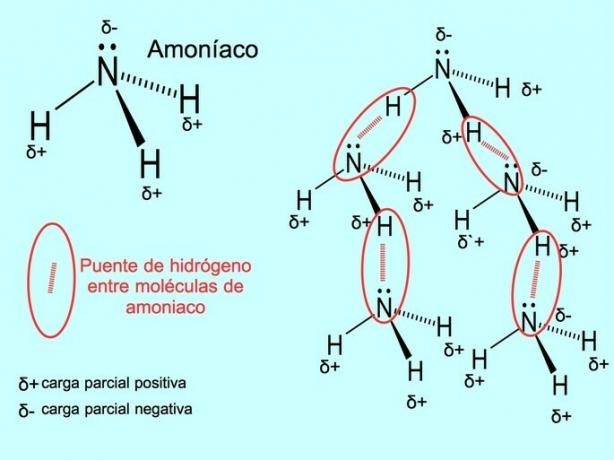
수소 결합 또는 결합
수소 결합 또는 수소 결합은 분자 사이에 설정되는 결합입니다. 분자의 수소가 산소, 질소 또는 불소에 공유 결합될 때 발생합니다. 산소, 질소 및 불소는 전기 음성도가 높은 원자이므로 전기 음성도가 낮은 다른 원자와 공유할 때 전자를 더 강하게 끌어당깁니다.
물 분자 H 사이에는 수소 결합이 있습니다.2O 및 암모니아 NH3 그림이 보여주듯이:
다음 항목에 관심이 있을 수 있습니다.
- 원자와 분자.
- 유기 및 무기 화합물의 예.
- 금속 및 비금속
참고문헌
Zumdahl, S.S., Zumdahl, S.A. (2014) 화학. 아홉 번째 판. 브룩스 / 콜. 벨몬트.
Commons, C., Commons, P. (2016) 하이네만 화학 1. 5판. 피어슨 오스트레일리아. 멜버른.



