Teigiamų arba neigiamų jonų apibrėžimas

Kaip jau žinome, atomai juos formuoja subatominės dalelės. Iš trijų subatominių dalelių tipų tik neutronai neturi elektrinio krūvio. Užtat protonai turi teigiamą elektrinį krūvį, o elektronai - neigiamą. Tik elektronai, užimantys atomo periferiją, gali būti perkelti iš vieno atomo į kitą, o branduolyje esantys protonai palaiko jų skaičių stabilų. Šioje DĖSTYTOJO pamokoje pamatysime, kas atsitiks, kai atomai ar molekulės gaus arba neteks elektronų. Tai yra, mes pamatysime teigiamų arba neigiamų jonų apibrėžimas ir pavyzdžiai.
Indeksas
- Kas yra jonai? Lengvas apibrėžimas
- Jonų susidarymas: elektroafinumas ir elektronegatyvumas
- Kas yra neigiami jonai? Su pavyzdžiais
- Kas yra teigiami jonai? Su pavyzdžiais
Kas yra jonai? Lengvas apibrėžimas.
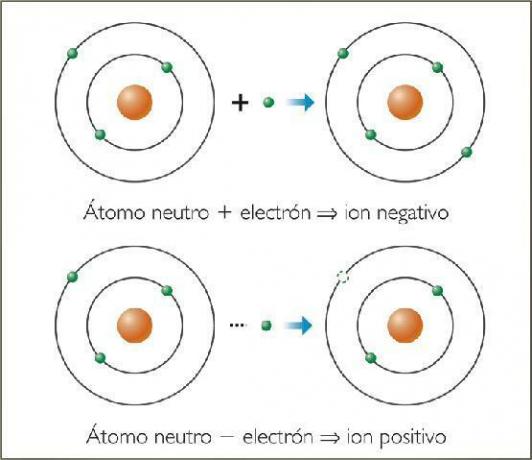
A jonų yra bet koks atomas ar molekulė su grynuoju elektriniu krūviu. Tai yra, vienas su kitu susietas atomas arba atomų rinkinys, kurio elektriniai krūviai jiems nėra kompensuojama. Šis krūvių dekompensavimas įvyksta, kai vienas ar keli elektronai prisijungia arba palieka atomą ar atomų rinkinį.
Taigi jonai yra įkrautų atomų ar molekulių, dėl elektronų (subatominių dalelių su neigiamu krūviu ir nereikšminga mase) padidėjimo ar praradimo.
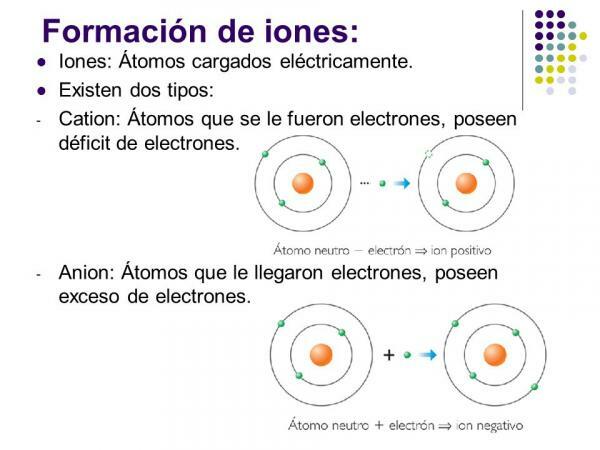
Jonų tipai: monatominiai ir polatominiai
Jei atsižvelgsime į jonų sudėtį, išskiriami du tipai: monatominiai jonai ir poliaatominiai jonai.
- Kaip rodo pavadinimas, monatominiai jonai tuos, kuriuos suformuoja a vienas atomas.
- Joniniai junginiai o poliaatominiai jonai yra tie, kuriuose atomai yra kovalentiškai surišti (jungtyje dalijasi viena ar daugiau elektronų porų) ir pateikia daugybę neutronai molekulėje skiriasi nuo bendro elektronų skaičiaus.
- poliaatominiai jonai juose paprastai yra deguonies ir jie paprastai turi struktūrą su centriniu atomu, aplink kurį yra išdėstyti likusieji molekulę sudarantys elementai.
- monatominių jonų krūvis tipinių elementų (lentelės 1 ir 2 šeimos bei periodinės lentelės 13–17 šeimos) galima lengvai išskaičiuoti, jei yra žinoma jų vieta periodinėje lentelėje. Tokiais atvejais atomai įgyja ar praranda elektronus, kad savo valentiniame apvalkale pasiektų savo laikotarpio tauriųjų dujų konfigūraciją (s2p6) arba kas yra tas pats, įvykdyti okteto taisyklė.
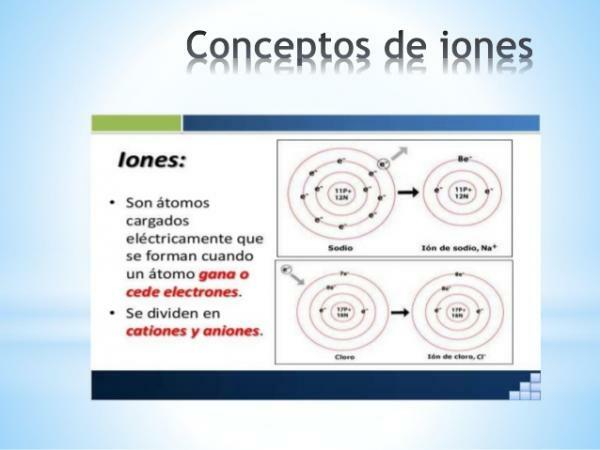
Vaizdas: „Slideshare“
Jonų susidarymas: elektroafinumas ir elektronegatyvumas.
Atomų ar molekulių gebėjimas susidaro jonai lemia dvi periodinės savybės: elektroafiniškumas ir elektronegatyvumas. Abi savybės per tam tikrą laiką padidėja ir sumažėja, kai mes nusileidžiame per periodinės lentelės grupę ar šeimą.
elektroafiniškumas, dar vadinamas elektronų giminingumu, yra atomo savybė, kuri apibrėžiama kaip atomo galimybė pritraukti elektronus. Junginių atveju panaši savybė vadinama elektronegatyvumas kuris apibrėžiamas kaip atomo galimybė pritraukti elektronus, kai jis užmezga ryšį su kitu atomu. Abi savybės taip apibrėžia elemento polinkį gaudyti ar prarasti elektronus.
Joninės jungtys
Kietos formos jonai sudaro junginius arba joniniai kristalai (druskos), susidarę derinant skirtingų ženklų jonus, sujungtus naudojant joninės jungtys. Geriausiai žinomas šio tipo junginių pavyzdys yra įprasta druska (natrio chloridas: NaCl).
Joninis ryšys susideda iš skirtingo ženklo jonų sąjungų, naudojant elektrostatines traukos jėgas (trauką tarp priešingo ženklo krūvių). Į šio tipo jungtis įsikiša elementai, kurių elektronegatyvumas arba elektrofinitetas yra labai skirtingi (metaliniai ir nemetaliniai elementai). Daugeliu atvejų šie joniniai junginiai yra tirpsta vandenyje ir kiti poliniai tirpikliai.
Vandeniniuose tirpaluose joniniai junginiai disocijuoja į laisvuosius jonus, kurie vadinami elektrolitai, nes dėl jo buvimo tirpale vanduo elgiasi kaip elektros laidininkas.
Kas yra neigiami jonai? Su pavyzdžiais.
neigiami jonai Jie vadinami anijonai. Visais atvejais tai yra nemetalinių elementų atomai arba molekulės, kuriose yra nemetalinių elementų. Šiems elementams būdingas labai didelis elektrofinitetas ir elektronegatyvumas. Tai yra, jie yra jonai, kuriuos sudaro elementai su didelis polinkis gaudyti elektronus.
Monatominiai anijonai: apibrėžimas ir pavyzdžiai
Jie yra nemetalinių elementų (periodinės lentelės 13–17 grupės) atomų suformuoti anijonai, įgiję vieną ar daugiau elektronų. Šie anijonai turi bendrą tauriųjų dujų elektroninę struktūrą (-as)2p6) jo tolimiausiame elektronų apvalkale (valentinis apvalkalas).
Pavyzdžiai:
- Chlorido jonas: Cl-
- Fluoro jonas: F-
- Jonų jodidas: Aš-
- Sulfido jonas: S-2
- Nitrido jonas: N-3
Poliaatominiai anijonai: apibrėžimas ir pavyzdžiai
Jie yra neigiamai įkrauti jonai, kuriuos sudaro du ar daugiau nemetalinių elementų atomų, sujungtų kovalentinėmis jungtimis. Jie yra labiausiai paplitę poliaatominiai jonai. Dažniausiai polatominiai anijonai yra oksoanionai, kuriuos sudaro nemetalinis centrinis atomas ir kuriuose yra deguonies.
Paprastai jie laikomi cheminiais junginiais, gautais, kai rūgštus junginys praranda vieną ar daugiau protonų (H+). Šie poliaatominiai anijonai gali išlaikyti šiek tiek vandenilio savo struktūroje, o tai suteikia jiems tam tikrą rūgšties pobūdį (gebėjimą atsisakyti protonų).
Pavyzdžiai:
- Nitratinis jonas: NO3-
- Permanganato jonas: MnO4-
- Fosfato jonas: PO4-3
- Vandenilio karbonatas arba bikarbonato jonas: HCO3-
- Sulfito jonas: SO3-2
Vaizdas: Naturopatija
Kas yra teigiami jonai? Su pavyzdžiais.
Vadinami teigiami jonai catijimai. Beveik visais atvejais tai yra metalinių elementų atomai arba molekulės, kuriose yra metalinių elementų. Šiems elementams būdingas labai mažas elektrofinitetas ir elektronegatyvumas, todėl jie rodo aiškų polinkį prarasti elektronus.
Monatominiai katijonai: apibrėžimas ir pavyzdžiai
Tai jonai, turintys teigiamą krūvį (dėl elektronų praradimo), kuriuos sudaro vienas metalinio elemento atomas. Šiuo atveju katijonas susidaro prarandant elektronus, kurie leidžia elementui ištuštinti savo tolimiausią elektroninį sluoksnį ir įgyti tauriųjų dujų konfigūraciją (-as)2p6) nuo žemesnio lygio. Jie yra labiausiai paplitusi katijonų rūšis.
Pavyzdžiai:
- Vandenilis arba hidrono katijonas (dar vadinamas protonu): H+
- Natrio katijonas: Na+
- Geležies (III) katijonas arba geležies katijonas: Fe+3
- Kalcio katijonas: Ca+2
- Vario (II) arba vario katijonas: Cu+2
Poliatominiai katijonai: apibrėžimas ir pavyzdžiai
Poliatominiai katijonai yra tie, kuriuos sudaro du ar daugiau atomų. Jie yra reti, daugiausia yra vadinamųjų homopolitatominių katijonų, kuriuose yra daugiau nei vienas to paties elemento atomas, esant trihidrogeno jonui, tai yra viena iš labiausiai paplitusių molekulių visata. Polatominiai katijonai, kuriuos sudaro skirtingų elementų atomai, nėra įprasti, tačiau jiems būdingi vandenilio ir laikoma kilusia, kai pagrindinis junginys sugauna protoną (H+).
Pavyzdžiai:
- Amonio katijonas: NH4+
- Oksonio katijonas: HO3+
- Fosfonio katijonas: PH3+
- Trihidrogeno katijonas arba protonuotas molekulinis vandenilis: H3+
- Dimercury katijonas: Hg2+2
Vaizdas: planetos
Jei norite perskaityti daugiau panašių į Neigiami ir teigiami jonai: apibrėžimas ir pavyzdžiai, rekomenduojame įvesti mūsų kategoriją Atomas.
Bibliografija
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Pagrindinė chemija. Madridas: Unedas



