Atomo struktūra ir charakteristikos

Vaizdas: „SlidePlayer“
Atomai yra mūsų pasaulio dalis. Visa materija yra sudaryta iš atomų, todėl svarbu geriau suprasti, iš ko jie susideda ir kokios yra jų funkcijos. Šioje Dėstytojo pamokoje mes jums pasakysime, kas yra atomo sandara ir charakteristikos. Jei norite sužinoti daugiau apie daleles, kurios sudaro visą medžiagą, toliau skaitykite šį straipsnį.
Indeksas
- Kas yra atomai?
- Atomo struktūra
- Pagrindinės atomo savybės
- Kas yra izotopai?
- Kaip atomai randami gamtoje?
Kas yra atomai?
atomas tai yra mažiausias vienetas, į kurį materiją galima padalyti neprarandant cheminių savybių, tai yra cheminių elementų savybių. Atomas yra visa, ką galima pamatyti ar paliesti, - nuo žvaigždžių iki jūsų šio ryto pusryčių - kilmė.
Atmetę jo cheminių savybių praradimą, galime sakyti, kad atomas susideda iš skirtingų dalelių, vadinamų subatominėmis dalelėmis. Yra trys subatominių dalelių tipai -protonai, neutronai ir elektronai- su skirtingomis savybėmis.
Šios dalelės yra sugrupuotos skirtingais skaičiais, kad susidarytų cheminiai elementai (deguonis, anglis ir kt.), Tačiau jie visada pasiskirstys laikydamiesi fiksuotos struktūros.

Vaizdas: „Google“ svetainės
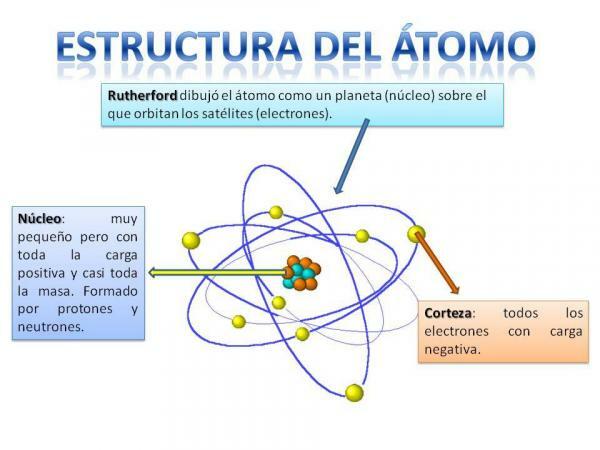
Atomo struktūra.
Atomo struktūra yra fiksuota, tai yra, mes galime turėti įvairių tipų atomus (vandenilio atomą, deguonies atomą ir kt.), tačiau jų subatominės dalelės visada yra organizuojamos panašiai kaip planetų sistema.
Jūs tikrai prisiminsite, kaip organizuota Saulės sistema: Saulė yra centre ir aplink nuo to planetos sukasi apibūdindamos skirtingas orbitas, kai kurios yra arčiau, o kitos tolimesnės Saulė. Atomų atveju centre yra šerdis, kurio forma panaši į gervuoges ir sudarytas iš neutronai ir protonai.
Aplink šerdį yra Žievė kuri yra sritis, per kurią elektronai. Anksčiau buvo manoma, kad elektronai apibūdina tam tikras orbitas, panašiai kaip ir planetos, nors dabar taip yra žino, kad šios orbitos nėra taip tiksliai apibrėžtos ir yra labiau panašios į sritis, kuriose mes esame labiau linkę atsidurti elektronai.
Paveikslėlis: REA - „Plan Ceibal“
Pagrindinės atomo savybės.
Tęsdami šią atomo struktūros ir savybių pamoką, svarbu sutelkti dėmesį į elementus, dėl kurių atomas laikomas tokiu.
Tam mes turime atsakyti į šį klausimą: Kodėl visi atomai nusprendžia save tam tikru būdu užsisakyti? Atsakymas paprastas: taip yra dėl elektros patrauklios jėgos. Atomo branduolį sudaro neutronai, neturintys elektros krūvio, ir protonai, turintys teigiamą elektrinį krūvį. o elektronai turi neigiamą elektros krūvį, todėl tarp branduolio ir elektronų yra panaši patraukli jėga gaminamas tarp dviejų magneto polių, tačiau nėra pakankamai stiprus, kad elektronai galėtų „nukristi“ į šerdis.
Tai geriau suprasti, jei atsižvelgsime į šerdies dydis: jei atomas turėtų, pavyzdžiui, futbolo stadiono matmenis, branduolys turėtų rutulio matmenį centre iš lauko Kiek patraukli jėga turėtų būti futbolo kamuolys, kad stadiono balintojai ant jo nukristų!
Neutronų funkcija
Dabar jums gali kilti klausimas, ir kokį vaidmenį vaidina neutronai? Nepaisant to, kad neturi elektrinio krūvio, neutronai turi didžiulį vaidmenį atome: jie sudaro 99% masės. Jei tai padės prisiminti, galime pasakyti, kad atomas yra tarsi trijų draugų gauja: sunkusis neutronas, teigiamas protonas ir neigiamas elektronas, kuris eina aplink neutroną ir elektronas.
Elektronų judėjimas
Šiuo metu noriu, kad grįžtume prie kažko, ką palikome rašalinėje: orbitos, kurias elektronai apibūdina aplink branduolį. Mes tai buvome pasakę elektronai sukasi aplink branduolį kaip planetos daro aplink Saulę, kai kurios yra arčiau nei kitos, kodėl jos tai daro? Elektronai sukasi viename ar kitame apvalkale pagal energiją, kurią jie turi nutolti nuo branduolio, tai yra, tie elektronai, kurie yra arčiau branduolio, neturi pakankama jėga nutolti nuo branduolio, o atokiausiuose plutos apvalkaluose (orbitalėse) esantys žmonės turi daugiau energijos ir galėjo nutolti nuo branduolio. šerdis. Be to, kiekvienoje orbitoje maksimali talpa yra 8 elektronai (okteto taisyklė).
Atomo dalelės
Grįšime prie kito požiūrio, kurį darėme anksčiau, bet nepaaiškinome: atomai yra sudaryti neutronai, protonai ir elektronai, kurie visada derina tą pačią branduolio ir plutos struktūrą, tačiau tai daro skirtingu skaičiumi, kad susidarytų skirtingi cheminiai elementai. Kaip mes galime gauti tiek elementų, apjungiančių tik 3 rūšių daleles? Cheminiams elementams, kuriuos jūs kada nors matėte vaizduojamus periodinėje lentelėje, būdingas tam tikras atominis skaičius.
atominis skaičius (Z) Jis nurodo protonų skaičių šio tipo atomų branduolyje, kuris yra lygus elektronų skaičiui normaliomis sąlygomis. Taigi, pavyzdžiui, visi atomai, turintys 6 protonus (Z = 6), bus anglies atomai, ir jie turės tas pačias chemines savybes; atomai, turintys 5 protonus (Z = 5), bus boro atomai, turintys tokias pačias chemines savybes kaip vienas kitas ir skirtingi nei anglies atomai. Jums nereikia painioti atomo skaičiaus su atomine mase arba masės numeris (A), kuri yra neutronų ir protonų svorio suma (elektronų svoris yra nereikšmingas viso branduolio svorio atžvilgiu).

Vaizdas: „SlidePlayer“
Kas yra izotopai?
Gamtoje galime rasti skirtingų elementų „potipių“ izotopai. Esu tikras, kad tam tikru momentu girdėjote apie anglį 14 - radioaktyvųjį anglies izotopą, kuris, be kita ko, naudojamas fosilijų amžiui nustatyti. Izotopai yra du atomai su vienodu protonų skaičiumi (tas pats atominis skaičius), bet skirtingas neutronų skaičius (skirtinga atominė masė). To paties elemento izotopai paprastai įvardijami kartu su elemento pavadinimu ir jo atomine mase.
Mūsų pavyzdyje abu izotopai yra anglis, todėl jų atominis skaičius yra 6 (Z = 6), bet anglies 12 („įprasta“ anglies) atominė masė yra 12, palyginti su anglies 14 atomine mase 14. To paties elemento izotopai turi labai panašias chemines ir fizines savybes. Anglies 14 atveju, skirtingai nuo anglies 12, tai yra radioaktyvus izotopas, kurio yra visuose elementuose, kuriuose yra anglies, įskaitant gyvas būtybes.
Tuo mes baigsime šią atomo struktūros ir savybių pamoką. Tikimės, kad tai jums padėjo.

Vaizdas: jūsų užduotys
Kaip atomai randami gamtoje?
Atomus galima rasti atskirai, tačiau pats normaliausias dalykas yra juos rasti sujungti į grupes paskambino molekulės.
Molekulės gali būti sudarytos iš to paties elemento atomų (pvz., Deguonies molekulės, sudarytos iš dviejų deguonis) arba grupėmis, turinčiomis skirtingų elementų atomus (du vandenilio ir vienas deguonies atomus) sudaro Vanduo). Šios elementų grupės vadinamos molekulėmis, kurias savo ruožtu galima derinti tarpusavyje ir formuojant vis sudėtingesnes grupes pagal jų reaktyvumą ir cheminį afinitetą Šaltinis cheminiai ryšiai.
Jei norite perskaityti daugiau panašių į Atomo struktūra ir charakteristikos, rekomenduojame įvesti mūsų kategoriją Atomas.

