Kas yra CHEMINĖS FORMULĖS ir kam jos skirtos [SANTRAUKA + VAIZDO ĮRAŠAI]
Nors neatrodo, periodinės lentelės cheminiai elementai Jie mus supa iš visų pusių. Tačiau dažnai jie nerandami atskirai, o formuoja įvairių cheminių elementų molekules ar makromolekules. Cheminės formulės yra šių junginių grafinė išraiška ir naudojamos jų nomenklatūrai standartizuoti. Šioje MOKYTOJO pamokoje pamatysime kas yra cheminės formulės ir kam jos skirtos. Prisijunkite prie mūsų ir sužinokite daugiau!
The chemines formules yra grafinė elementų, sudarančių cheminiai junginiai.
Šios cheminės formulės nėra savavališkos, tačiau jos atitinka kai kurias griežtos taisyklės chemijos nomenklatūros, nustatytos IUPAC (Tarptautinė grynosios ir taikomosios chemijos sąjunga).
Cheminės formulės taip pat suteikia mums informacijos apie elementai, sudarantys molekulę, tai, pavyzdžiui, nurodo kiekvieno jį sudarančio atomo skaičių ir atitinkamas proporcijas, o kartais net ir jo tipą. Cheminis ryšys kuri egzistuoja tarp tų elementų.
Kiekviena egzistuojanti molekulė ar makromolekulė atitinka savo cheminę formulę, kad ir kaip būtų
įvairių tipų formulės. Kiekvienas iš šių tipų suteikia mums skirtingą informaciją apie molekulę, tačiau jie visi padeda suprasti ją cheminė prigimtis ir tai padeda mums suprasti, kas vyksta cheminėse reakcijose ir kaip vienas junginys gali virsti kitais.Tačiau norint suprasti šią cheminę nomenklatūrą, reikia turėti tam tikrų chemijos žinių, nes jie paklūsta gana specializuotai techninei kalbai.

Vaizdas: Slideplayer
The chemines formules atstovauja cheminių simbolių sąjunga, su atitinkama kiekvieno atomo raide Periodinė elementų lentelė, ir apatiniai indeksai, kurie yra skaičiai, nurodantys tų skaičių atomai molekulėje
Chemijoje (tiek organinėje, tiek neorganinėje) yra tam tikrų fragmentų ar junginių, kurie rodo tam tikrą struktūrinį ir funkcinį pasikartojimą ir yra identifikuojami pagal pavadinimus specifinis. Kai šiuose fragmentuose yra laisvųjų elektronų, kurie nėra bendrinami, jie vadinami radikalais ir yra nestabilūs, labai reaktyvūs junginiai, kurių pusinės eliminacijos laikas yra trumpas.
Radikalų pavyzdžiai yra metilo grupės CH3, nitratų grupės NO3, hidroksilo grupės OH- arba radikalas Cl-. Tačiau jie yra žinomi kaip funkcinės grupės, kai tai yra atomai arba atomų grupės, prijungtos prie grandinės anglies dioksidas (su įvairia anglimi) ir kurie yra atsakingi už reaktyvumą ir chemines savybes molekules.
Šios grupės yra ypač svarbios organinėje chemijoje (žmogaus biomolekulės iš esmės yra anglis ir vandenilis). Kai kurie funkcinių grupių pavyzdžiai yra karbonilo grupė = C = O arba karboksilo grupė -COOH.

Vaizdas: Monogramas.com
Kaip sakėme, yra keletas cheminių formulių tipų. Kiekviena iš šių formulių suteikia mums skirtingą informaciją apie molekules, todėl ji tarnauja tam tikram tikslui, be jokios formulės, kuri apskritai būtų geresnė ar blogesnė už kitą.
Išskiriame šias cheminių formulių klases:
Empirinės formulės
Empirinės formulės yra paprasčiausios formulės, vaizduojančios cheminę molekulę, kartais sakoma, kad tai yra minimalios formulės. Šios formulės parodo kiekvieno molekulės elemento atomų proporciją, supaprastintą iki sveikų skaičių, visada mažiausio. Šios formulės pavyzdys yra CH3 (metilo grupė), turinti tris vandenilio atomus ir vieną anglies atomą.
Tačiau šios formulės kartais gali sukelti klaidingą supratimą apie molekulės sudėtį. Taip atsitinka, kai formulė nenurodo tikrojo atomų skaičiaus molekulėje, kaip ir peroksido atveju vandenilis, kurio empirinė formulė yra HO, kai formulė turėtų būti H2O2 (du vandenilio atomai ir du deguonies). Taigi tai vyksta pagal nomenklatūros susitarimą, nes abu indeksai yra lygūs, jie yra supaprastinti.
Tačiau kai kurie junginiai gali būti pavaizduoti tik empirinėmis formulėmis, nes jie sudaryti iš jonų tinklų. Tai atsitinka, pavyzdžiui, valgomojoje druskoje arba natrio chloride, kuris vaizduojamas kaip NaCl, o tai rodo, kad kiekviename natrio druskoje yra chloro.
Molekulinės formulės
Šios formulės yra gana paprastos, jos tiesiog išreiškia atomų tipą ir kiekvieno jų skaičių kovalentinėje molekulėje. Tai formulės, kuriose cheminiai elementai ir skaičius pateikiami linijiniu būdu (apatinis indeksas. Tokio tipo formulės pavyzdys yra tada, kai gliukozė pavadinta C6H12O6, kuri išreiškia tą gliukozę. Gliukozės molekulę sudaro šeši anglies atomai, dvylika vandenilio atomų ir šeši iš jų deguonies.
Molekulinės formulės yra plačiai naudojamos, kartais sakoma, kad tai tikrosios molekulių formulės. Daugeliu atvejų jos sutampa su empirinėmis formulėmis, pavyzdžiui, CO2.
Pusiau išvystytos formulės
Pusiau išvystytos formulės yra formulės, panašios į molekulines formules, nes jos taip pat išreiškia atomus, sudarančius molekulę, ir jų skaičių, bet taip pat pateikti informaciją apie cheminius ryšius (pavaizduotus linijomis tarp atomų) ir ryšio tarp jį sudarančių anglies atomų tipą (jei jie yra paprasti, dvigubi arba trigubai). Pusiau sukurta formulė yra naudinga identifikuojant molekulę sudarančius radikalus ir jos cheminę struktūrą (ryšiai tarp anglies ir vandenilio atomų nepavaizduoti).
Gliukozės atveju jos pusiau išvystyta formulė yra CH2OH - CHOH - CHOH - CHOH -CHOH - CHO ir, kaip matyti, anglies, vandenilio ir deguonis yra tokie patys kaip molekulinėje formulėje (atitinkamai šeši, dvylika ir šeši) ir visos viengubos jungtys (tik gliukozė turi ryšius paprastas). Todėl ši formulė yra sudėtingesnė nei molekulinė formulė.
Pusiau sukurtos formulės kartais vadinamos sutrumpintos ir yra bene plačiausiai naudojama formulių klasė. naudojami, ypač organinėje chemijoje, nors ir neleidžia stebėti tikrosios molekulių geometrijos.
Sukurta formulė
Sukurtos formulės yra šiek tiek sudėtingesnės nei pusiau išvystytos. Šio tipo formulėse ryšys ir kiekvieno atomo vieta molekulėje vaizduojami Dekarto plokštumoje, kol pavaizduojamas visas junginys.
Struktūrinė formulė
Struktūrinė formulė yra grafinis molekulės struktūros vaizdas erdvėje, suteikiantis mums informacijos apie atomų tvarką ir pasiskirstymą erdvėje. Šioje formulėje taip pat parodytos cheminės jungtys, sudarančios molekulę, jei jos yra viengubos, dvigubos ar trigubos. Todėl ši formulė yra ta, kuri suteikia mums daugiausiai informacijos apie molekulę.
Tokio tipo formulės labiau naudojamos profesionaliame chemijos pasaulyje, nes leidžia daug aiškiau matyti chemines reakcijas ar naujų molekulių sintezę.
Lewiso formulės
Tai sudėtingos, labai specifinės ir techninės formulės. Jie taip pat žinomi kaip Lewis diagramos arba struktūros ir yra panašūs į sukurtas molekulių formules, bet Be to, nurodyti elektronai, kuriuos atomai dalijasi kiekvienoje cheminėje jungtyje, kurie skiriasi priklausomai nuo atomų valentingumo. dalyvauja.
Šiose formulėse ryšiai tarp atomų vaizduojami linijomis (taip pat nurodančiomis, ar jos yra viengubos, dvigubos ar trigubos) arba taškų pora. Pavieniai elektronai arba elektronai, kurie nėra bendri ryšyje, yra pavaizduoti taškais aplink atomą, kurį jis atitinka.

Vaizdas: organinė chemija
Rašant formules kartais daroma nuoroda įoksidacijos numeris elemento (jis dažnas joniniuose junginiuose). Tai yra teigiamų ir neigiamų skaičių rinkinys susietas su kiekvienu elementu.
- Oksidacijos skaičius gali būti interpretuojamas kaip elektronų skaičius kad elementas dalijasi kovalentiniu ryšiu arba pereina į joninį ryšį.
- Kai oksidacijos ženklas virš atomo yra neigiamas, reiškia, kad šis elementas fiksuoja elektronus, o šalia jo esantis skaičius yra užfiksuotų elektronų skaičius. Todėl oksidacijos būsena –1 reiškia, kad elementas paima vieną elektroną, –2 – du ir t.t.
- Kai oksidacijos požymis yra teigiamas, atomas atiduoda elektroną, o šį ženklą lydintis skaičius yra atiduotų elektronų skaičius. Panašiai, oksidacijos būsena +1 reiškia, kad ji duoda vieną elektroną, +2 – du ir t.t.
Tai daugiausia tinka joniniai junginiai, kovalentiniuose ryšiuose, nors aiškinimas yra panašus, jis nėra tas pats, nes šie ryšiai dalijasi elektronais. Šiuose junginiuose kalbama apie daugiau elektronneigiamų elementų, kurie traukia daugiau elektroninės poros ir palieka daugiau neigiamo krūvio, priklausomai nuo elektronų skaičiaus, kurį jie pritraukia. Tai galima pamatyti Lewiso formulės.
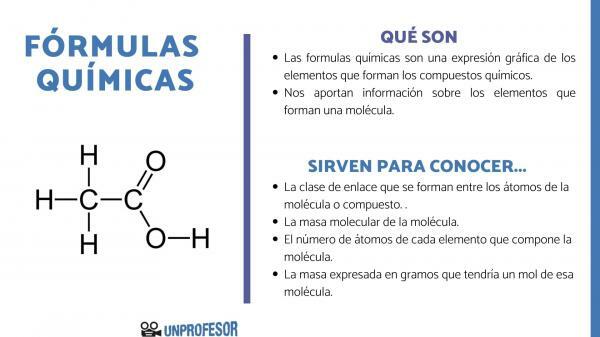
Jei norite sužinoti, kam skirtos cheminės formulės, turite atsižvelgti į tai, kad šis skaičius leidžia mums gauti kai kurias molekulių informacija, kokie jie yra:
- The nuorodos klasė kurios susidaro tarp molekulės ar junginio atomų. Šie ryšiai paprastai yra kovalentiniai, kai juose dalyvauja nemetaliniai ir joniniai atomai, jei jie yra metaliniai ir nemetaliniai ryšiai.
- The molekulinė masė molekulės.
- The atomų skaičius kiekvieno elemento, sudarančio molekulę. Kartais tai vadinama šimtmečio molekulės sudėtimi.
- Masė, išreikšta gramų kad turėtų vieną molį tos molekulės.
Joninio junginio, pavyzdžiui, natrio chlorido arba paprastosios druskos, atveju tai nėra visiškai teisinga kalbėti apie molekules (nors kartais tai daroma), kad jos linkusios formuoti didelius agregatus ir makromolekulių. Šiuo atveju junginio formulė padeda pamatyti, kurie jonai jį sudaro ir kokiu kiekiu.


