Delen van een atoom en hun kenmerken
Afbeelding: Answers.tips
Atomen zijn de basiselementen die vorm materie, aanwezig zijn in alle toestanden van materie. Het zijn hele kleine elementen, onmogelijk om door het menselijk oog te zien, maar ze zijn echt belangrijk voor ons universum. Om beter te begrijpen hoe atomen zijn en hoe ze werken, gaan we het in deze les van een LERAAR hebben over: delen van een atoom en hun kenmerken.
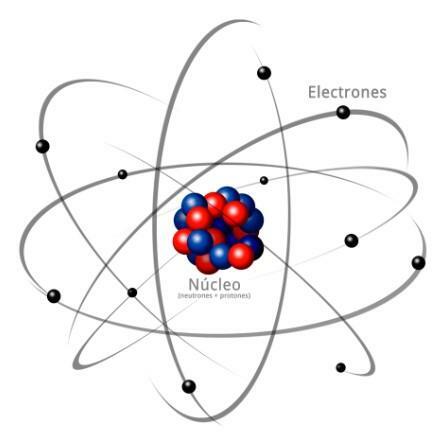
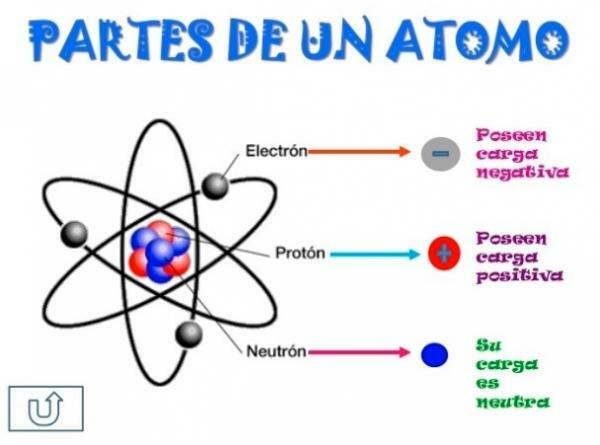
Alle atomen zijn opgebouwd uit a kern en een korst. De kern, zoals de naam al aangeeft, is het centrale deel van het atoom, waar de deeltjes waarvan de lading positief is en die worden genoemd protonen, en de deeltjes waarvan de lading neutraal is, dat wil zeggen, ze hebben geen elektrische lading, en krijgen de naam neutronen. De massa van beide deeltjes, zowel protonen als neutronen, is vergelijkbaar. Alle atomen van hetzelfde chemische element hebben een gelijk aantal protonen, krijgen dit nummer de naam van het atoomnummer en gebruiken de letter Z om het weer te geven.
Aan de andere kant is er de Cortex
wat is de buitenste deel van het atoom. In de bast vinden we de elektronen, die negatief geladen deeltjes zijn. De elektronen roteren met grote snelheid rond de kern op verschillende niveaus, het zijn deeltjes die veel kleiner zijn dan die in de kern.Omdat het neutrale neutronen, positieve protonen en negatieve elektronen zijn, het atoom heeft een neutrale elektrische lading, omdat ze hetzelfde aantal protonen hebben als elektronen. Hoewel er gevallen zijn waarin elektronen in minder of grotere aantallen zijn dan protonen, waardoor de lading het atoom is negatief of positief, in dit geval krijgt het de naam ion, anion als het negatief is of kation als het positief is.
Afbeelding: Brainly
Om verder te gaan met deze les over de delen van een atoom en hun kenmerken, moeten we praten over de evolutie die de delen van het atoom hebben gehad, sinds het atoommodel is in de loop van de tijd veranderd dankzij de studies van wetenschappers. Houd er rekening mee dat verschillende van de modellen die we gaan uitleggen, verouderd zijn en niet worden gebruikt op dit moment, maar ze zijn nodig om de evolutie van de wetenschappelijke gemeenschap over dit onderwerp te begrijpen.
De historische evolutie van het atoommodel wordt gekenmerkt door: wetenschappers volgen:
- Dalton-model: Het eerste atoommodel was het werk van John Dalton in 1803. Het is een zeer primitief model dat veel elementen mist, zoals de aanwezigheid van elektronen en protonen.
- Thomson-model: John Thomson slaagde erin een completer atoommodel te maken dan dat van Dalton, door verschillende sleutelelementen toe te voegen. Thomson ontdekte het bestaan van elektronen en positieve en negatieve ladingen.
- Nagaoka-model: De Japanse natuurkundige Nagaoka was het niet eens met het model van Thomson, hij dacht dat het atoom een grote positief geladen kern moest hebben waarop negatief geladen elektronen draaien. Zijn theorie wordt Saturnus genoemd, omdat hij elektronen vergeleek met de ringen van Saturnus. Vaak wordt dit model niet genoemd, maar het is essentieel om de grote stap die op dit moment wordt gezet te begrijpen.
- Rutherford-model: Het model van Rutherford was gebaseerd op het bestaan van een positief geladen kern waarop negatief geladen elektronen roteerden. Dit model lijkt erg op dat van Nagaoka, zijnde van zeer nabije jaren, hoewel het Japanse model eerder is.
- Bohr-model: Bohr dacht dat de elektronen op grote afstand van de gelaagde kern moesten worden gescheiden en dat het aantal van deze orbitale deeltjes gelijk moest zijn aan het atoomnummer. Zijn model begrijpt ook dat het aantal elektronen in elke schil varieert, met minder elektronen in de eerste schil dan in de laatste.
- Schrödinger-model: Schrödinger brak de overtuiging dat elektronen kleine deeltjes zijn die rond de kern draaien. De Oostenrijkse wetenschapper beweerde dat elektronen bewogen door middel van een golffunctie, dat wil zeggen door orbitale vorm.
- Dirac-model: Dirac wijzigde de ideeën van Schrödinger voor zijn model, met behulp van de "Dirac-vergelijking" om een correcter beeld te geven van de orbitale vorm van elektronen.
