Forskjell mellom endotermiske reaksjoner og eksoterme reaksjoner
EN endoterm reaksjon krever strøm mens a eksoterm reaksjon frigjør energi. Denne klassifiseringen av kjemiske reaksjoner tar hensyn til energideltakelse enten som en reaktant eller som et produkt.
Energi er evnen til å utføre arbeid eller å produsere varme. Husk at kjemiske reaksjoner innebærer en omorganisering av atomer mellom stoffer med brudd eller dannelse av kjemiske bindinger. Generelt ledsages denne dannelsen eller bruddet av kjemiske bindinger av endringer i systemets energi.
| Endoterm reaksjon | Eksoterm reaksjon | |
|---|---|---|
| Definisjon | Kjemisk reaksjon der energi absorberes. | Kjemisk reaksjon der energi frigjøres i form av varme. |
| Opprinnelse til energi | Av miljøet | Av systemet |
| Potensiell energi | Lavere i reaktanter enn i produkter. | Høyere i reaktanter enn i produkter. |
| Produksjon | Ikke spontan | Spontan |
| Intern energiforandring | AE> 0; indre energiendring større enn null. | AE <0; indre energi endres mindre enn null. |
| Temperatur | Avtar | Øker |
| Eksempler | Reaksjoner i fotosyntese og syntese generelt. | En brennende fyrstikk, forbrenningsreaksjoner. |
Hva er en endoterm reaksjon?
En kjemisk reaksjon er endoterm når absorberer energi fra miljøet. I dette tilfellet overføres varmen fra utsiden til innsiden av systemet. Når vi plasserer et termometer mens den endotermiske reaksjonen pågår, synker temperaturen.
Ordet "endoterm" stammer fra gresk endon som betyr "innsiden" og terme som betyr "varme". Endotermiske reaksjoner fortsetter ikke spontant.
Hvor kommer energien fra i endotermiske reaksjoner?
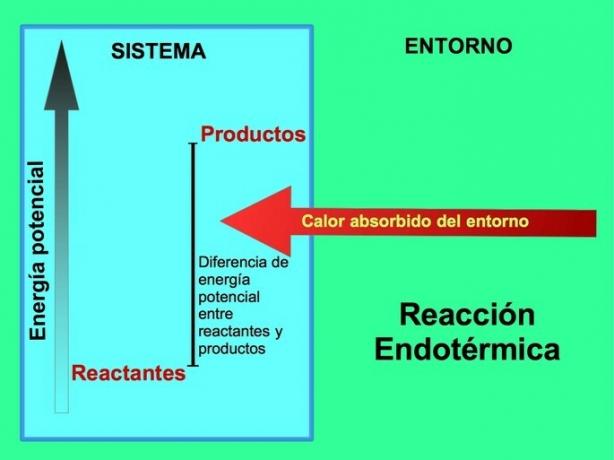
I endotermiske reaksjoner kommer energien fra omgivelsene utenfor systemet. Mengden potensiell energi til produktene er større enn den potensielle energien til reaktantene. Derfor er det nødvendig å tilsette energi til reaktantene for at reaksjonen skal fortsette. Denne energien kommer fra varmen fra miljøet.
For eksempel, fotosyntese er en endoterm prosess, der planter fanger solenergi for å produsere glukose fra karbondioksid og oksygen:

Produktene fra fotosyntese-reaksjonen, glukose og oksygen, har større potensiell energi i forhold til reaktantene, karbondioksid og vann. Andre eksempler på endotermiske kjemiske reaksjoner med mengden energi som brukes:

Eksempler på endoterm reaksjon
Det er ikke bare i kjemilaboratoriet reaksjoner oppstår. På daglig basis finner vi også situasjoner der endotermiske reaksjoner oppstår.
Lage mat
Selv om det kanskje ikke virker som det, er prosessen med å lage mat endoterm. For å konsumere visse matvarer, må vi gi varme.
Øyeblikkelig kaldpose
Kaldepakker som brukes til å behandle ujevnheter eller forstuinger er fylt med vann, men når de ristes eller bankes, brytes en kapsel som inneholder ammoniumnitrat inn. Å blande ammoniumnitrat med vann er en endoterm reaksjon som får posen til å avkjøles.
Du kan være interessert i å se Forskjellen mellom varme og temperatur.
Hva er en eksoterm reaksjon?
EN eksoterm reaksjon er en der energi strømmer ut av systemet. Denne energien frigjøres i form av varme, så plassering av et termometer i reaksjonssystemet øker temperaturen.
Ordet "eksoterm" er dannet av exo som betyr "utad" og termer, som betyr "varme". Eksoterme reaksjoner kan forekomme spontant og i noen tilfeller være eksplosive, for eksempel kombinasjonen av alkalimetaller og vann.
Hvor kommer energien fra i eksoterme reaksjoner?
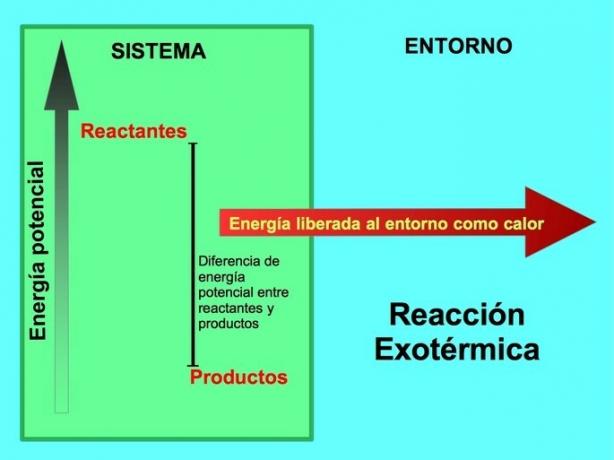
I en kjemisk reaksjon er reaktanter forbindelsene som transformerer og gir opphav til produkter. For eksempel, når natrium Na reagerer med klor Cl, er dette reaktantene og produktet er natriumklorid NaCl:

Både reaktanter og produkter har lagret potensiell energi. Vi vet fra lenergibesparelse ey at energi verken er tapt eller oppnådd, så reaktantenes energi må være lik den til produktene.
I en eksoterm reaksjon, lreaktanter har mer potensiell energi sammenlignet med produkter, slik at overflødig energi frigjøres som varme. I dette tilfellet betraktes også energi som en del av produktene:

I enhver eksoterm prosess blir en del av den potensielle energien lagret i kjemiske bindinger omgjort til termisk energi gjennom varme.
Eksempler på eksoterm reaksjon
Vaskemiddel
Når vi oppløser litt pulvervaskemiddel med vann i hendene, kan vi føle en liten oppvarming.
Forbrenning av innenlands gass
Forbrenningen av gasser til husholdningsbruk, som metan eller butan, innebærer den kjemiske reaksjonen med oksygen med dannelse av karbondioksid og vann, og frigjøring av energi. Dette er en typisk eksoterm reaksjon i daglig bruk:
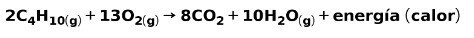
Energien som frigjøres i forbrenningsprosessen brukes til å lage mat.
Du kan også være interessert i å vite hva de er Åpent system, lukket system og isolert system.


