De 10 typer kjemiske grunnstoffer (forklart og klassifisert)
Hvor mange kjemiske grunnstoffer må finnes i universet? Dette spørsmålet har fortsatt en lang vei å gå, siden forskere av og til lager sine egne kunstige kjemiske elementer.
Det vi imidlertid kan svare på er hvor mange typer kjemiske grunnstoffer som må finnes, noe vi vil finne ut av neste.
- Relatert artikkel: "De 11 typene kjemiske reaksjoner"
Typer av kjemiske elementer
I naturen kan vi finne alle slags stoffer. Disse stoffene finnes vanligvis ikke i ren tilstand, men er et resultat av kombinasjonen av forskjellige elementer eller materialer som gjennom forskjellige reaksjoner, prosesser og tidsperioder har gitt opphav til alle slags saken. Det er ingenting i universet som ikke er et resultat av kombinasjonen av atomer som tilhører forskjellige typer kjemiske grunnstoffer, som vi vil se i dybden.
Imidlertid, før vi ser på typer kjemiske elementer, la oss gjøre en liten gjennomgang av videregående skole og huske hva kjemiske elementer er.
Vi kaller "kjemisk element" materie som er sammensatt av samme type atom, det vil si et stoff som er atom rent.
Kjemiske elementer kan ikke brytes ned til enklere og er klassifisert i det periodiske systemet av elementene som rene materialer i universet.Men vær forsiktig! Vi må ikke forveksle elementer med enkle stoffer, siden i visse tilfeller kan to eller flere atomer av det samme elementet komponere molekyler gruppert på forskjellige måter som får noen av de fysiske egenskapene til det aktuelle elementet til å variere, disse tilfellene er isotoper. For eksempel er diamant og karbon stoffer laget av det kjemiske elementet karbon (C). men det er organisert på forskjellige måter og resulterer i to helt forskjellige materialer.
Carl sagan Den sa at vi er stjernestøv som reflekterer på stjerner. Denne vakre frasen er ikke bare en metafor, men et vitenskapelig faktum. Kjemiske elementer dannes, så langt vi vet, at stjerner inne er et resultat av kompleks fusjons- og atomfisjonprosesser som genererer stadig tyngre grunnstoffer, resultatet av en prosess som kalles nukleosyntese.
De fleste kjente elementene kan hentes fra naturen, funnet spontant eller danner forbindelser med andre grunnstoffer som uran (U), karbon (C), silisium (Si), sølv (Ag) eller gull (Au). Andre, derimot, har blitt produsert i laboratorier som americium (Am), berkelium (Bk) eller curium (Cm). Uansett metode for å skaffe den eller hvis den er tilstede i naturen, avhengig av dens egenskaper, vil det aktuelle kjemiske elementet ha noen bruksområder eller andre.
For tiden er rundt 118 kjemiske grunnstoffer kjent, selv om det er tatt i betraktning at mennesker har vært i stand til å produsere nye grunnstoffer, er det et spørsmål om tid før det periodiske system utvides.
- Du kan være interessert i: "De to elektrisitetstyper (forklart)"
Hovedtyper av kjemiske elementer
De viktigste typene av kjemiske elementer er representert i det periodiske system, et system av klassifisering laget av den russiske kjemikeren Dmitri Mendeleev (1834-1907) som la grunnlaget for det 1869. Kjemiske elementer er visuelt ordnet ut fra deres egenskaper og egenskaper.
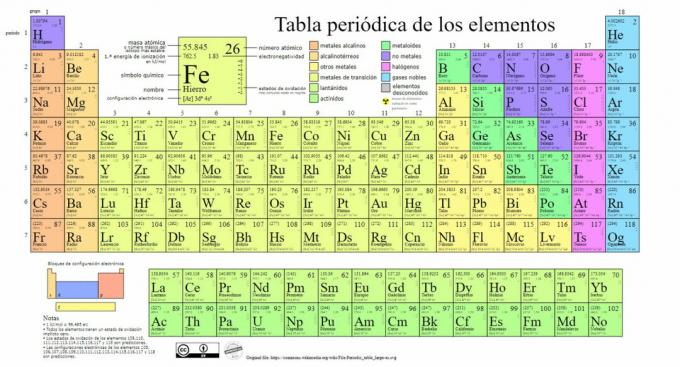
Over tid og etter hvert som kjemi gjorde viktige vitenskapelige funn, ville denne tabellen blitt utvidet fortløpende, når formen den har i dag med de 118 elementene som er kjent hittil.
For øyeblikket kan vi i denne tabellen finne følgende typer kjemiske elementer:
1. Metaller
Metaller er kjemiske elementer som vanligvis inneholder mellom en og tre elektroner i atomets siste bane, elektroner som enkelt kan overføres gjør dem til ledere av varme og elektrisitet.
Metaller er vanligvis formbare og duktile, med en karakteristisk glans hvis intensitet avhenger av bevegelsen til elektronene som utgjør atomene deres. Mesteparten av tiden er metaller faste ved romtemperatur, bortsett fra kvikksølv.
Blant metallene finner vi gull (Au), sølv (Ag), kobber (Cu) og aluminium (Al) hvis fysiske egenskaper gjør dem til fantastiske ledere av elektrisitet, selv om deres tilstedeværelse i naturen er veldig variert, gjenspeiles i forskjellen mellom vektene.
Det antas at 75% av de kjemiske elementene som finnes i naturen er metaller, mens de resterende 25% vil bestå av edelgasser, metalloider og andre typer.
Det er klassifiseringer innenfor denne kategorien, som finner aktinider, lantanider, overgangsmetaller, alkalimetaller, jordalkalimetaller og andre metaller.
- Relatert artikkel: "10 matvarer med mye sink"
1.1. Lanthanider
Lantanidelementer finnes i forekomster som består av mange mineraler. De er hvite metaller som oksiderer lett når de kommer i kontakt med luft. Blant dem finner vi Lanthanum (La), Promethium (Pm), Europium (Eu) og Ytterbium (Yb).

- Du kan være interessert i: "De fem typene kjemiske bindinger: Slik er materie sammensatt"
1.2. Actinides
Alle isotoper av aktinider er radioaktive. Blant dem finner vi actinium (Ac), uran (U), plutonium (Pu) og einsteinium (Es).
1.3. Overgangsmetaller
Overgangsmetaller er lokalisert i den sentrale delen av det periodiske systemet. Hovedkarakteristikken er det ha elektronisk konfigurasjon av "d" -banen delvis fylt med elektroner.
I denne gruppen er det stoffer av alle slag, og i henhold til den bredeste klassifiseringen vil det tilsvare kjemiske elementer fra 21 til 30, fra 39 til 48, fra 71 til 80 og fra 103 til 112, som er totalt førti, og blant dem ville vi finne vanadium (V), ruthenium (Ru), sølv (Ag), tantal (Ta) og lawrencio (Lr).

1.4. Alkalimetaller
Alkalimetallene er en gruppe på seks grunnstoffer som består av litium (Li), natrium (Na), kalium (K), rubidium (Rb), cesium (Cs) og francium (Fr). De er skinnende, myke metaller, svært reaktive ved normal temperatur og trykk og mister lett sitt ytre elektron, lokalisert i "s" orbital.
1.5. Alkaliske jordarter
Jordalkalimetallene er en gruppe elementer der vi finner beryllium (Be), magnesium (Mg), kalsium (Ca), strontium (Sr), barium (Ba) og radium (Ra). Navnet kommer fra navnet på oksidene, "jordene", som har grunnleggende eller alkaliske egenskaper.
Alkaliske jordarter de er hardere enn alkaliske, skinner og er gode elektriske ledere. De er mindre reaktive enn alkaliske og fungerer som gode reduserende midler. De har evnen til å danne ioniske forbindelser, og de har alle to elektroner i ytterste skall.

1.6. Andre metaller
Kategorien "andre metaller" er en type stoffer som finnes her fordi du egentlig ikke vet hvor du skal legge dem.
De er metalliske elementer som er plassert i det periodiske systemet sammen med metalloidene i p -blokken. De pleier å være myke med lave smeltepunkter. Blant dem er aluminium (Al), indium (In), tinn (Sn) og vismut (Bi) blant andre.

2. Ingen metaller
Ikke -metaller har vanligvis mellom fem og syv elektroner i sin siste bane, en egenskap som gjør at de får elektroner i stedet for å gi dem opp, og dermed klarer de å ha åtte elektroner som dermed stabiliserer dem som atomer.
Dette elementene de er veldig dårlige ledere av varme og elektrisitet. I tillegg til dette har de ikke en karakteristisk glans, er ikke veldig formbare, ikke veldig seige og er veldig skjøre i fast tilstand. De kan ikke rulles eller tøyes, i motsetning til metaller.
De er stort sett viktige for biologiske systemer, siden de er tilstede i organiske forbindelser, som svovel (S), karbon (C), oksygen (O), hydrogen (H) og jod (I).

- Relatert artikkel: "De 20 typene edelstener (beskrevet og med bilder)"
3. Metalloider
Som navnet antyder, er metalloider en mellomklassifisering mellom metaller og ikke-metaller som har egenskaper for begge gruppene. Dette skyldes det faktum at de har fire atomer i sin siste bane, en mellomliggende mengde til metaller og ikke-metaller.
Disse kjemiske elementene leder elektrisitet bare i en retning, slik at den ikke kan gjøres i motsatt retning som den gjør i metaller. Et eksempel på dette finnes i silisium (Si), en metalloid som brukes til fremstilling av halvlederelementer for elektronikkindustrien takket være denne egenskapen.
Andre metalloider er: bor (B), arsen (As), antimon (Sb) og polonium (Po).

4. Halogener
Halogener er en gruppe på seks elementer som de har en tendens til å danne molekyler sammensatt av to atomer (diatomiske) som er veldig kjemisk aktive på grunn av deres elektronegativitet.
Disse stoffene vises vanligvis i form av ioner, det vil si elektrisk ladede molekyler, som i dette tilfellet er mononegative, sterkt oksiderende. Dette betyr at halogener er etsende og etsende stoffer.
Halogenene er: fluor (F), klor (Cl), brom (Br), jod (I), astat (At) og tenese (Ts).

5. Edle gasser
Edelgassene er en gruppe på syv hvis naturlige tilstand er gassformig. De vises vanligvis i form av diatomiske molekyler med veldig lav reaktivitet, det vil si at de ikke reagerer med andre elementer som komponerer andre stoffer og av samme grunn er de kjent som inerte gasser. Dette er fordi det i sin siste bane er det maksimale antallet elektroner som er mulig for det nivået, totalt åtte.
Denne utvalgte gruppen av elementer består av helium (He), neon (Ne), argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) og oganeson (Og), tidligere kjent som ununoctium.


