Moeller-diagram: hva det er, hvordan det brukes i kjemi og eksempler
Kjemi kan være spesielt komplisert, så ethvert verktøy som letter læring for de som blir introdusert for det er velkomne.
En av de mest populære metodene for å bli kjent med Madelungs regel og elektronkonfigurasjonen til atomer er Moeller-diagrammet, en grafisk mnemonisk regel som gjør det veldig enkelt å se i hvilke orbitaler elektroner.
Neste vi skal finne ut hva Moeller-diagrammet består av, hvordan det forholder seg til Madelungs regel, hvordan det brukes ved hjelp av noen få løste eksempler, og hvilke kjemiske elementer som ikke følger denne strategien.
- Relatert artikkel: "De 5 typene kjemiske bindinger: dette er hvordan materie er sammensatt"
Hva er Moeller-diagrammet?
Moeller-diagrammet, også kjent som regnmetoden eller regelen for diagonaler, er en grafisk og mnemonisk metode for å lære Madelungs regel, en teknikk for å kjenne og skrive den elektroniske konfigurasjonen av kjemiske elementer.
Dette diagrammet er karakterisert ved å tegne diagonaler gjennom søylene til orbitalene, fra topp til bunn fra høyre til venstre. Gjennom Moeller-diagrammet defineres en rekkefølge i fyllingen av orbitalene, som vil bli definert av tre kvantetall: n, l og ml.
Moeller-diagrammet fungerer i henhold til følgende:

Hver kolonne tilsvarer en annen orbital som elektronene til et atom sirkulerer gjennom, subatomære partikler som har negativ ladning. De aktuelle orbitalene er: s, p, d og f, hver med et spesifikt rom for å huse elektroner og derfor forskjellige energinivåer.
Hvis vi tegner diagonalene eller pilene i nevnte betydning, har vi at den første orbitalen er 1s. Den andre pilen begynner med 2s orbital. Den tredje pilen krysser 2p og 3s. Den fjerde diagonalen er 3p og 4s. Den femte diagonalen er 3d, 4p og 5s og så videre. Moeller-diagrammet er en introduksjonsteknikk for de som begynner å studere de elektroniske konfigurasjonene av elementene i det periodiske systemet i kjemi.
- Du kan være interessert i: "De 6 hovedgrenene til naturvitenskapen"
Madelungs regel
Siden Moeller-diagrammet er den grafiske representasjonen av Madelungs styre (også kjent som Klechkovskys styre i noen land) må vi først vite hva det handler om. I henhold til denne regelen må fyllingen av orbitalene til et atom følge følgende to regler:
Madelungs første regel
Orbitalene med de laveste verdiene av n + l fylles ut først, med n som hovedkvantetallet, og l er det orbitale vinkelmomentet..
For eksempel tilsvarer 3d-orbitalen n = 3 og l = 2. Derfor er n + l = 3 + 2 = 5. I stedet tilsvarer 4s-orbitalen n = 4 og l = 0, derfor n + l = 4 + 0 = 4. Fra dette er det fastslått at elektronene fyller 4s-orbitalen først før 3d-en, fordi 4s = 4 mens 3d = 5.
- Relatert artikkel: "De 11 typene kjemiske reaksjoner"
Madelungs andre regel
Hvis to orbitaler har samme verdi på n + l, vil elektronene okkupere den med den laveste verdien av n først.
For eksempel har 3d-orbitalen en verdi på n + l = 5, identisk med den for 4p-orbitalen (4 + 1 = 5), men siden 3d-orbitalen har den laveste verdien for n, vil den fylles ut først enn 4p orbital.
Fra alle disse observasjonene og reglene kan følgende rekkefølge nås ved fylling av atomorbitalene: 1s 2s 2p 3s 3p 4s 3d 4p. Selv om denne rekkefølgen er fast, er det komplisert å huske den utenat, og det er derfor det er et Moeller-diagram som grafisk representerer rekkefølgen.
- Du kan være interessert i: "De 9 postulatene til Daltons atomteori"
Trinn å følge når du bruker Moeller-diagrammet
Som vi har kommentert i forrige avsnitt, bruker Madelungs regel formelen n + l for å fastslå hva orbitaler fylles før og fra det bestemmer hva som er den elektroniske konfigurasjonen til et element fast bestemt. Imidlertid representerer Moeller-diagrammet allerede dette grafisk og enkelt, så det er nok å følge kolonner i samme diagram og tegn diagonaler for å finne ut i hvilken rekkefølge orbitalene til hver element.
For å oppdage den elektroniske konfigurasjonen til et atom og i hvilke orbitaler elektronene er lokalisert, må vi først vite atomnummeret Z. Tallet Z tilsvarer antall elektroner i et atom, så lenge dette atomet er nøytralt, eller hva som er det samme, at det ikke er et ion, verken positivt (kation) eller negativt (anion).
Når vi kjenner Z for et nøytralt atom, vet vi allerede hvor mange elektroner et nøytralt atom i det elementet vanligvis har. Med dette i tankene vil vi begynne å tegne diagonalene på Moeller-diagrammet. Vi må ta i betraktning at hver type orbital har ulik kapasitet til å huse elektroner, som er:
- s = 2 elektroner
- p = 6 elektroner
- d = 10 elektroner
- f = 14 elektroner
Den stopper ved orbitalen der det siste elektronet gitt av Z har vært okkupert.
Moeller diagram eksempler
For bedre å forstå hvordan Moeller-diagrammet fungerer, skal vi nedenfor se noen få praktiske eksempler på innstilling av elektronkonfigurasjonen til forskjellige elementer.
Beryllium
For å etablere den elektroniske konfigurasjonen til et nøytralt beryllium (Be) atom, må vi først se etter det i det periodiske systemet, en jordalkali som er plassert i den andre kolonnen og andre raden i tabellen. Atomnummeret er 4, derfor er Z = 4 og det har også 4 elektroner.
Med alt dette i betraktning, skal vi bruke Moeller-diagrammet for å se hvordan de 4 elektronene til dette elementet er plassert. Vi starter med å lage diagonaler i nevnte betydning, fra topp til bunn og fra høyre til venstre.
Når vi fyller orbitaler, Det anbefales å sette antallet elektroner som finnes i hver av dem som et overskrift. Siden 1s er den første orbitalen og den opptar to elektroner, vil vi skrive den:

Siden vi fortsatt har frie elektroner, fortsetter vi å fylle ut orbitaler. Neste er 2s orbital og, som med 1s, okkuperer den 2 elektroner, derfor 2s2. Siden vi allerede har alle elektronene godt plassert i orbitalene til det nøytrale atomet til Be, kan vi si at den elektroniske konfigurasjonen til dette elementet er:

Vi forsikrer oss om at vi har gjort det bra ved å legge til overskriftene: 2 + 2 = 4
- Du kan være interessert i: "Molekylær kinetisk teori: materiens 3 tilstander"
Kamp
Grunnstoffet fosfor (P) er et ikke-metall som finnes i tredje rad og kolonne 16 i det periodiske systemet, med Z = 15, derfor har den totalt 15 elektroner som må okkupere orbitalene.
Etter å ha sett det forrige eksemplet, kan vi bevege oss litt fremover og lokalisere 4 av elektronene i de samme orbitalene som beryllium har for sine 4 elektroner, mangler 9 elektroner Plus.

Etter 2s orbital går neste diagonal inn i 2p orbital og ender ved 3s orbital. 2p-orbitalen kan oppta 6 elektroner, og i tilfellet med 3-er bare 2. Dermed ville vi ha:
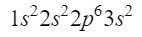
For øyeblikket har vi 12 elektroner godt plassert, men vi har fortsatt 3 igjen å gå. Vi lager en ny diagonal og denne gangen går vi inn gjennom 3p orbitalen i henhold til Moeller-diagrammet, en orbital som har plass til 6 elektroner, men siden vi bare har 3 elektroner igjen, vil ikke denne orbitalen være helt okkupert, og setter 3 som et overskrift. For å avslutte fosfor, er dens elektroniske konfigurasjon som følger:

Vi sørger for at vi har gjort det bra ved å legge til overskriftene: 2 + 2 + 6 + 2 + 3 = 15
Zirkonium
Grunnstoffet zirkonium (Zr) er et overgangsmetall som finnes i kolonne 4 og rad 5 og har en Z = 40. Ved å forkorte banen ved å utnytte det forrige eksemplet, kan vi lokalisere de første 18 elektronene.
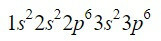
Etter 3p-orbitalen er de neste som skal fylles opp, som veileder oss med Moeller-diagrammet, 4s-, 3d-, 4p- og 5s-orbitalene, med kapasitet for henholdsvis 2, 10, 6 og 2 elektroner.

Fullføring av de første ni orbitalene i diagrammet legger til totalt 20 elektroner, etterlater de 2 gjenværende elektronene som er plassert i neste orbital, 4d. Dermed er elektronkonfigurasjonen til det nøytrale elementet zirkonium:
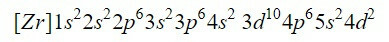
Vi sørger for at vi har gjort det bra ved å legge til overskriftene: 2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 2 = 40
Oksygen
Her ser vi et litt mer komplisert eksempel som er oksygen (O). Denne gassen finnes i kolonne 16 og rad 2 i det periodiske systemet, det er et ikke-metall og har et atomnummer på 8.
Så langt, ser på de andre eksemplene, vil vi tro at dens Z = 8, men det er ikke så enkelt siden denne gassen er av en spesiell natur, nesten alltid i form av et ion med en ladning på -2.
Dette betyr at selv om et nøytralt oksygenatom har 8 elektroner som indikert med atomnummeret, har det Det er sant at i naturen har den mer, i tilfelle 10 (8 elektroner + 2 elektroner eller, om du foretrekker, -8 ladning) elektrisk -2).
Så i dette tilfellet, antall elektroner som vi må lokalisere i orbitalene er ikke 8 men 10 elektroner, som om vi lokaliserte elektronene til det kjemiske elementet neon som har Z = 10.
For å forstå dette, trenger vi bare å gjøre det samme som vi har gjort i de tidligere tilfellene, bare med tanke på at vi jobber med et ion (anion):
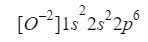
Vi sørger for at vi har gjort det bra ved å legge til overskriftene: 2 + 2 + 6 = 10
Kalsium
Noe som ligner på oksygen skjer med kalsium (Ca), bare i dette tilfellet snakker vi om et kation, det vil si et ion med en positiv ladning.
Dette grunnstoffet finnes i kolonne 2 rad 4 i det periodiske system med et atomnummer på 20, men i Naturen presenteres vanligvis i form av et ion med en positiv ladning +2, noe som betyr at dens elektroniske ladning er 18 (- 20 + 2 = 18; 20 elektroner - 2 elektroner = 18 elektroner).
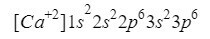
Vi sørger for at vi har gjort det bra ved å legge til overskriftene: 2 + 2 + 6 + 2 + 6 = 18
Unntak fra Moeller-diagrammet og Madelungs regel
Selv om Moeller-diagrammet er veldig nyttig for å forstå Madelungs regel og for å vite hvordan elektronene til de forskjellige kjemiske elementene er lokalisert, er sannheten at det ikke er ufeilbarlig. Det er visse stoffer hvis sammensetning ikke følger det vi har forklart.
Elektronkonfigurasjonene deres skiller seg eksperimentelt fra de som er forutsagt av Madelungs regel av kvanteårsaker.. Blant disse grunnstoffene som ikke følger standardene har vi: krom (Cr, Z = 24), kobber (Cu, Z = 29), sølv (Ag, Z = 47), rhodium (Rh, Z = 45), cerium ( Ce, Z = 58), niob (Nb; Z = 41), blant andre.
Unntak er svært hyppige når du fyller d- og f-orbitalene. For eksempel, når det gjelder krom, som skal ha en valenskonfigurasjon som slutter på 4s ^ 2 3d ^ 4 i henhold til Moeller-diagrammet og Madelungs regel, har det faktisk en valenskonfigurasjon på 4s ^ 1 3d ^ 5. Et annet merkelig eksempel er sølv, som i stedet for å ha 5s ^ 2 4d ^ 9 som den siste har 5s ^ 1 4d ^ 10.
