Charakterystyka grup TABELI OKRESOWEJ

Zdjęcie: Nauki przyrodnicze
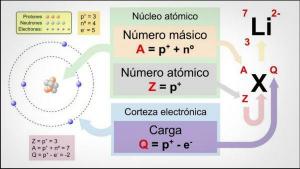
układ okresowy pierwiastków zamów wszystko pierwiastki chemiczne znane do tej pory. Choć może się wydawać, że jest inaczej, elementy te są ułożone według ostrożnych reguł, które obowiązują od rozmiaru do reaktywności, przechodząc przez inne właściwości, takie jak liczba elektronów w ostatniej powłoce atomowy.
Układ okresowy jest w istocie tabelą, która składa się z wierszy i kolumn. Wiersze, które są ułożone w formie poziomy, z tzw okresy podczas kolumny, w pionie, czy grupy. Ale co decyduje o tym, że dwa elementy są w tej samej lub w innej grupie? W tej lekcji od NAUCZYCIELA zobaczymy, że charakterystyka grup układu okresowego pierwiastków.
Indeks
- Jakie są grupy układu okresowego pierwiastków? Ile grup znajduje się w układzie okresowym?
- Charakterystyka grupy 1 (IA)
- Charakterystyka grupy 2 (IIA)
- Charakterystyka grup 3 do 12 (B)
- Charakterystyka grupy 13 (IIIA)
- Charakterystyka grupy 14 (VAT)
- Charakterystyka grupy 15 (VA)
- Charakterystyka grupy 16 (VIA)
- Charakterystyka grupy 17 (VIIA)
- Charakterystyka grupy 18 (VIIIA)
Jakie są grupy układu okresowego pierwiastków? Ile grup znajduje się w układzie okresowym?
Zanim zaczniemy mówić o charakterystyce grup w układzie okresowym, musimy wiedzieć, z czego składa się ten układ. Aby zbadać dotychczas odkryte pierwiastki chemiczne, Mendelejew wymyśliłem ten wzór w tabeli: układ okresowy pierwiastków. W układzie okresowym pojawiają się poziome wiersze i pionowe kolumny. Kolumny układu okresowego nazywamy grupami, a elementy tej samej grupy (w tej samej kolumna) mają taką samą wartościowość i podobne właściwości chemiczne, które zobaczymy poniżej Sekcje.
Obecnie układ okresowy jest złożony z 18 grup. Każdej z grup przypisany jest kod, aw niektórych przypadkach nazwa zwyczajowa.
18 grup układu okresowego pierwiastków Oni są:
- Grupa 1, IA lub metale alkaliczne. Składa się z litu (Li), sodu (Na), potasu (K), rubidu (Rb), cezu (Cs) i francu (Fr)
- Grupa 2, II A lub metale ziem alkalicznych. Składa się z berylu (Be), magnezu (Mg), wapnia (Ca), strontu (Sr), baru (Ba) i radu (Ra).
- Grupa 3, IIIB lub rodzina Escandio. Składa się z: Skand (Sc), Itr (Y), Lutet (Lu), Lawrencio (Lr), Lantan (La), Aktyn (Ac).
- Grupa 4, IV B lub rodzina Titanium. Składa się z pierwiastków: tytanu (Ti), cyrkonu (Zr) i hafnu (Hf) oraz rutherfordu (Rf)
- Grupa 5, VB lub rodzina wanadu. W skład tej grupy wchodzą pierwiastki: wanad (V), niob (Nb), tantal (Ta) i dub (Db).
- Grupa 6, VIB lub rodzina chromu. Grupa 6 obejmuje: Chrom (Cr), Molibden (Mo), Wolfram lub Tungsten (W) i Seaborgium (Sg).
- Grupa 7, VIIB lub rodzina manganowa. Grupę 7 tworzą: Mangan (Mn), Technet (Tc), Ren (Re) i Bohrio (Bh).
- Grupa 8, VIIIB lub rodzina żelaza. Grupa 8 obejmuje: żelazo (Fe), ruten (Ru), osm (Os) i has (Hs).
- Grupa 9, IXB lub rodzina kobaltu. Grupa 9 składa się z: Kobaltu (Co), Rodu (Rh), Irydu (Ir) i Meitnerium (Mt).
- Grupa 10, rodzina XB lub Nickel. W skład tej grupy wchodzą: Nikiel (Ni), Pallad (Pd), Platyna (Pt) i Darmstadium (Ds) (wcześniej Ununnilio (Uun).
- Grupa 11, XIB, rodzina miedzi lub metali wybijanych. Do tej grupy należą: miedź (Cu), srebro (Ag), złoto (Au) i roentgen (Rg).
- Grupa 12, XIIB lub rodzina cynku. Grupę 12 tworzą: Cynk (Zn), Kadm (Cd), Rtęć (Hg) i Kopernik (Cn).
- Grupa 13, IIIA lub rodzina Boron. Utworzony przez Bor (B), Aluminium (Al), Gal (Ga), Ind (In), Tal (Tl) i Nihonium (Nh).
- Grupa 14, IVA, rodzina węglowa lub karbonidowa. Grupę 14 tworzą pierwiastki: węgiel (C), krzem (Si), german (Ge), cyna (Sn), ołów (Pb) i flerow (Fl).
- Grupa 15, V5, rodzina pnicógenos lub azotoidów. Składa się z: azotu (N), fosforu (P), arsenu (As), antymonu (Sb), bizmutu (Bi) i muscovio (Mc).
- Grupa 16, VIA, amfogeny, chalkogeny lub rodzina tlenu. Składa się z: tlenu (O), siarki (S), selenu (Se), telluru (Te), polonu (Po) i Livermorio (Lv).
- Grupa 17, VIIA lub halogeny. W skład tej grupy wchodzą: fluor (F), chlor (Cl), brom (Br), jod (I), astat (At) i tenese (Ts).
- Grupa 18, VIIIA lub gazy szlachetne. Grupę tworzą: hel (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe), radon (Rn) i oganesson (Og).
Druga klasyfikacja pierwiastków chemicznych
W obrębie pierwiastków chemicznych możemy znaleźć drugą klasyfikację grup układu okresowego.
- Grupy 1, 2, 13, 14, 15, 16, 17 i 18 należą do grupy A głównych elementów lub grup
- Natomiast grupy 3, 4, 5, 6, 7, 8, 9, 10, 11 i 12 należą do grupy B lub metali przejściowych.
Większość tych pierwiastków chemicznych można znaleźć w naturze, w postaci czystej lub w mieszaninach z innymi związkami lub pierwiastkami. Z drugiej strony, niektóre z nich, jak księstwo moskiewskie, to elementy sztuczne, stworzone przez człowieka w laboratoriach i nigdy nie spotykane w naturze. Tutaj odkryjemy Cię bardziej szczegółowo jak zorganizowany jest układ okresowy.

Obraz: Układ okresowy pierwiastków
Charakterystyka grupy 1 (IA)
Zaczynamy od analizy cech grup w układzie okresowym, mówiąc o elementy grupy 1 które mają następujące funkcje:
- Liczba utleniania +1. Są zatem bardzo elektrododatnie i mają niską energię jonizacji, ponieważ łatwo tracą ten elektron.
- Konfiguracja elektroniczna to ns1
- Są to najbardziej reaktywne chemicznie pierwiastki chemiczne, dlatego w naturze nie są izolowane, ale w postaci soli.
- Są to miękkie metale o małej gęstości i niskich temperaturach topnienia. Podczas ich cięcia lub topienia obserwuje się ich srebrny kolor i metaliczny połysk.
- Są plastyczny, ciągliwy i dobrymi przewodnikami ciepła i elektryczności.
- W reakcji z wodą tworzą wodorotlenki

Obraz: Udostępnianie slajdów
Charakterystyka grupy 2 (IIA)
grupa 2 elementów posiadają następujące cechy:
- Liczba utleniania +2
- Konfiguracja elektroniczna to ns2
- Niska energia jonizacji, która staje się coraz mniejsza w miarę schodzenia w grupie. Dlatego wszystkie z wyjątkiem berylu tworzą wyraźnie związki jonowe.
- Łatwo reagują z halogenami tworząc sole jonowe.
- Mają niską gęstość, są kolorowe i miękkie

Obraz: Udostępnianie slajdów
Charakterystyka grup 3 do 12 (B)
Ten zestaw grup nazywa się metale przejściowe lub blok d ponieważ, jeśli spojrzymy na jego konfigurację elektronową, orbital d jest częściowo wypełniony elektronami.
Mają zachowania pośrednie, to znaczy nie są bardzo reaktywne, nie są bardzo obojętne (mało reagentów), nie mają wyraźnie charakterystycznych stanów utlenienia ani stanu, gęstości ani właściwości zdefiniowane.

Obraz: odtwarzacz slajdów
Charakterystyka grupy 13 (IIIA)
Grupa 13Pomimo tego, że jest również dość pośredni pod względem swoich cech, widzimy, że jest nieco bardziej zdefiniowany niż poprzednie. Elementy grupy 13 mają:
- Posiadają stopień utlenienia +3, a w niektórych pierwiastkach również +1
- Są to zazwyczaj metaloidy o bardzo wysokiej temperaturze topnienia
- Zwykle mają typowe właściwości niemetaliczne

Obraz: Udostępnianie slajdów
Charakterystyka grupy 14 (VAT)
pierwiastki karbonidowe Są one również dość zróżnicowane i mają bardzo szczególną charakterystykę: gdy schodzimy w dół grupy, pierwiastki mają bardziej metaliczne właściwości; węgiel jest niemetalem, krzem i german są półmetalami, a w dalszej kolejności metalami są cyna i ołów.

Obraz: Slajdów
Charakterystyka grupy 15 (VA)
Kontynuując charakterystykę grup układu okresowego, porozmawiamy teraz o grupa 15 elementów:
- Są bardzo reaktywne w wysokiej temperaturze. Klasycznym przykładem jest reakcja azotu z tlenem i wodorem, która zachodzi tylko w wysokiej temperaturze lub ciśnieniu.
- Mają 5 elektronów walencyjnych.
- Wiązania kowalencyjne są zwykle tworzone między N i P, wiązania jonowe między Sb i Bi oraz innymi pierwiastkami.

Obraz: odtwarzacz slajdów
Charakterystyka grupy 16 (VIA)
Charakterystyka grupa 16 elementów Oni są:
- Mają sześć elektronów walencyjnych (ostatnia powłoka s2p4)
- Jego właściwości zmieniają się od niemetalicznych do metalicznych, wraz ze wzrostem liczby atomowej.
- Jego objętość atomowa, gęstość, promień anionu oraz temperatury topnienia i wrzenia zwiększają się w miarę przesuwania się w dół grupy.
- Jego ciepło właściwe i ciepło tworzenia wodorku zmniejszają się wraz ze spadkiem w grupie.

Obraz: odtwarzacz slajdów
Charakterystyka grupy 17 (VIIA)
Charakterystyka grupa 17 lub halogeny są następujące:
- Są to pierwiastki jednowartościowe, to znaczy mają tylko jedną liczbę walencyjną. W halogenach wartościowość wynosi -1.
- Zwykle łączą się z metalami, tworząc halogenki, halogenki lub hydraty.
- Mają niewielkie powinowactwo do tlenu, więc nie tworzą tlenków, ale w bardzo wysokich temperaturach.

Obraz: odtwarzacz slajdów
Charakterystyka grupy 18 (VIIIA)
I kończymy tę lekcję o charakterystyce grup układu okresowego, mówiąc o gazy szlachetne lub pierwiastki z grupy 18 które mają następujące cechy:
- Przedstawiają stan gazu w przyrodzie.
- Ich warstwa elektronowa lub ostatnia warstwa walencyjna jest kompletna, więc nie są zbyt reaktywne.
- Są bardzo obfite w przyrodzie. Po wodorze hel jest najpowszechniejszym pierwiastkiem w znanym wszechświecie.
- Mają niską temperaturę topnienia i wrzenia
- Wykazują negatywne powinowactwo elektroniczne
- Niektóre z nich są radioaktywne, co czyni je bardzo ważnymi z ekonomicznego punktu widzenia.

Obraz: odtwarzacz slajdów
Jeśli chcesz przeczytać więcej artykułów podobnych do Charakterystyka grup układu okresowego, zalecamy wpisanie naszej kategorii Atom.
Bibliografia
- Quimicas.net (lipiec 2015) Grupy pierwiastków chemicznych. Wyzdrowiał z https://www.quimicas.net/2015/07/grupos-de-elementos-quimicos.html
- Pacheco, A (s.f) Grupy układu okresowego, ich opis i charakterystyka Pozyskane z http://www.universidadcultural.com.mx/online/claroline/work/user_work.php? cmd = exDownload & authId = 7750 & assigId = 3 & workId = 131 & cidReset = true & cidReq = CIIS1_002
- Obszar naukowy (s.f) Grupy układu okresowego pierwiastków odzyskane z https://www.areaciencias.com/quimica/familias-de-la-tabla-periodica.html