Glutaminian (neuroprzekaźnik): definicja i funkcje
glutaminian pośredniczy w większości synaps pobudzających w ośrodkowym układzie nerwowym (OUN). Jest głównym mediatorem informacji czuciowych, ruchowych, poznawczych i emocjonalnych oraz bierze udział w tworzeniu wspomnień i ich odzyskiwaniu, występując w 80-90% synaps w mózgu.
Jakby to wszystko mało zasługiwało, ingeruje też w neuroplastyczność, procesy uczenia się i jest prekursorem GABA – Główny neuroprzekaźnik hamujący OUN. Czego więcej można chcieć od cząsteczki?
Co to jest glutaminian?
Możliwie jest jednym z najdokładniej przebadanych neuroprzekaźników w układzie nerwowym. W ostatnich latach jego badania rosły ze względu na jego związek z różnymi patologiami neurodegeneracyjnymi (takimi jak choroba Alzheimera), dzięki czemu jest silnym celem leków w różnych chorobach.
Warto również wspomnieć, że biorąc pod uwagę złożoność jego receptorów, jest to jeden z najbardziej skomplikowanych neuroprzekaźników do zbadania.
Proces syntezy
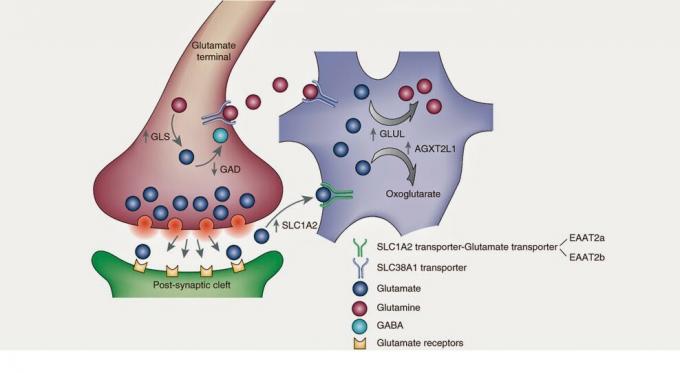
Proces syntezy glutaminianu rozpoczyna się w cyklu Krebsa, czyli cyklu kwasów trikarboksylowych. Cykl Krebsa to szlak metaboliczny lub, dla nas, aby zrozumieć,
następstwo reakcji chemicznych w celu wytworzenia oddychania komórkowego w mitochondriach. Cykl metaboliczny można rozumieć jako mechanizm zegara, w którym każdy bieg spełnia funkcja i prosta awaria części może spowodować uszkodzenie zegarka lub nie; godzina. Cykle w biochemii są takie same. Cząsteczka, poprzez ciągłe reakcje enzymatyczne – koła zębate zegara – zmienia swój kształt i skład, aby wywołać funkcję komórki. Głównym prekursorem glutaminianu będzie alfa-ketoglutaran, który w wyniku transaminacji otrzyma grupę aminową w glutaminian.Warto też wspomnieć o innym dość istotnym prekursorze: glutaminie. Kiedy komórka uwalnia glutaminian do przestrzeni pozakomórkowej, astrocyty - rodzaj komórki glejowy - odzyskaj ten glutaminian, który dzięki enzymowi zwanemu syntetazą glutaminy stanie się glutamina. Później, glutamina jest uwalniana przez astrocyty, która jest odzyskiwana przez neurony, aby ponownie przekształcić się w glutaminian. I prawdopodobnie więcej niż jeden zapyta: A jeśli muszą zwrócić glutaminę do glutaminianu w neuronie, dlaczego astrocyt przekształca słaby glutaminian w glutaminę? Cóż, ja też nie wiem. Być może chodzi o to, że astrocyty i neurony się nie zgadzają, a może jest to, że Neuronauka To takie skomplikowane W każdym razie chciałem dokonać przeglądu astrocytów, ponieważ ich współpraca stanowi 40% wszystkich obrót handlowy glutaminian, co oznacza, że większość glutaminianu jest odzyskiwana przez te komórki glejowe.
Istnieją inne prekursory i inne szlaki, za pomocą których odzyskuje się glutaminian uwalniany do przestrzeni pozakomórkowej. Na przykład, istnieją neurony, które zawierają specyficzny transporter glutaminianu – EAAT1/2 – który bezpośrednio odzyskuje glutaminian do neuronu i umożliwia zakończenie sygnału pobudzającego. W celu dalszego zbadania syntezy i metabolizmu glutaminianu polecam lekturę bibliografii.
Receptory glutaminianu
Jak zwykle nas uczą, każdy neuroprzekaźnik ma swoje receptory na komórce postsynaptycznej. Receptory znajdujące się na błonie komórkowej to białka, z którymi wiąże się neuroprzekaźnik, hormon neuropeptyd itp., aby spowodować szereg zmian w metabolizmie komórkowym komórki, w której się znajduje receptor. W neuronach zazwyczaj umieszczamy receptory na komórkach postsynaptycznych, chociaż tak naprawdę nie musi tak być.
Zwykle w pierwszym roku wyścigu uczą nas też, że istnieją dwa główne typy receptorów: jonotropowe i metabotropowe. Jonotropy to takie, w których gdy ich ligand – „klucz” receptora – wiąże się, otwierają kanały, które umożliwiają przejście jonów do komórki. Z drugiej strony, metabotropy, gdy wiążą się ligandy, powodują zmiany w komórce za pośrednictwem wtórnych posłańców. W tym przeglądzie omówię główne typy jonotropowych receptorów glutaminianu, chociaż zalecam przestudiowanie literatury w celu zrozumienia receptorów metabotropowych. Oto główne receptory jonotropowe:
- Odbiornik NMDA.
- Odbiornik AMPA.
- Łapacz kainado.
Receptory NMDA i AMPA i ich ścisły związek
Uważa się, że oba typy receptorów są makrocząsteczkami złożonymi z czterech domen transbłonowych – to znaczy składają się z czterech podjednostek, które przechodzą przez podwójną warstwę lipidową błony komórkowej - i oba są receptorami glutaminianu, które otwierają kanały kationowe - dodatnio naładowane jony. Ale mimo to znacznie się różnią.
Jedną z ich różnic jest próg, przy którym są aktywowane. Po pierwsze, receptory AMPA są znacznie szybciej aktywowane; podczas gdy receptory NMDA nie mogą być aktywowane, dopóki neuron nie ma potencjału błonowego około -50mV - neuron, gdy jest nieaktywny, ma zwykle około -70mV-. Po drugie, krok kationów będzie w każdym przypadku inny. Receptory AMPA osiągną znacznie wyższe potencjały błonowe niż receptory NMDA, które będą współpracować znacznie skromniej. W zamian receptory NMDA osiągną znacznie trwalsze aktywacje w czasie niż receptory AMPA. W związku z tym, te z AMPA aktywują się szybko i wytwarzają silniejsze potencjały pobudzające, ale szybko się dezaktywują. A te z NMDA potrzebują czasu, aby się aktywować, ale udaje im się utrzymać potencjał pobudzający, który generują znacznie dłużej.
Aby lepiej to zrozumieć, wyobraźmy sobie, że jesteśmy żołnierzami i że nasza broń reprezentuje różne receptory. Wyobraźmy sobie, że przestrzeń pozakomórkowa to rów. Mamy dwa rodzaje broni: rewolwer i granaty. Granaty są proste i szybkie w użyciu: zdejmujesz pierścień, wyrzucasz go i czekasz, aż wybuchnie. Mają duży destrukcyjny potencjał, ale kiedy już je wyrzucimy, to koniec. Rewolwer to broń, której załadowanie wymaga czasu, ponieważ musisz wyjmować bęben i wkładać kule jeden po drugim. Ale po załadowaniu mamy sześć strzałów, z którymi możemy przeżyć chwilę, choć z dużo mniejszym potencjałem niż granat. Nasze mózgowe rewolwery to receptory NMDA, a nasze granaty to receptory AMPA.
Ekscesy glutaminianu i ich niebezpieczeństwa
Mówią, że w nadmiarze nic nie jest dobre, aw przypadku glutaminianu jest to spełnione. Następnie przytoczymy niektóre patologie i problemy neurologiczne, z którymi związany jest nadmiar glutaminianu.
1. Analogi glutaminianu mogą powodować egzotoksyczność
Leki analogiczne do glutaminianu – czyli pełnią taką samą funkcję jak glutaminian – takie jak NMDA – od którego pochodzi nazwa receptora NMDA – może powodować efekty neurodegeneracyjne w dużych dawkach w najbardziej wrażliwych obszarach mózgu takie jak łukowate jądro podwzgórza. Mechanizmy zaangażowane w tę neurodegenerację są zróżnicowane i obejmują różne typy receptorów glutaminianu.
2. Niektóre neurotoksyny, które możemy spożywać w naszej diecie, powodują śmierć neuronów poprzez nadmiar glutaminianu
Różne trucizny niektórych zwierząt i roślin wywierają swoje działanie poprzez szlaki nerwowe glutaminianu. Przykładem jest trucizna z nasion Cycas Circinalis, trującej rośliny, którą możemy znaleźć na wyspie Guam na Pacyfiku. Ta trucizna spowodowała wysokie rozpowszechnienie Stwardnienie zanikowe boczne na tej wyspie, gdzie jej mieszkańcy spożywali ją codziennie, uważając ją za łagodną.
3. Glutaminian przyczynia się do niedokrwiennej śmierci neuronów
Glutaminian jest głównym neuroprzekaźnikiem w ostrych chorobach mózgu, takich jak zawał serca, zatrzymanie akcji serca, niedotlenienie przed / okołoporodowe. W tych zdarzeniach, w których w tkance mózgowej brakuje tlenu, neurony pozostają w stanie trwałej depolaryzacji; z powodu różnych procesów biochemicznych. Prowadzi to do trwałego uwalniania glutaminianu z komórek, a następnie przedłużonej aktywacji receptorów glutaminianu. Receptor NMDA jest szczególnie przepuszczalny dla wapnia w porównaniu z innymi receptorami jonotropowymi, a nadmiar wapnia prowadzi do śmierci neuronów. Dlatego nadaktywność receptorów glutaminergicznych prowadzi do śmierci neuronów z powodu zwiększonego stężenia wapnia wewnątrz neuronów.
4. Padaczka
Związek między glutaminianem a padaczką jest dobrze udokumentowany. Uważa się, że aktywność padaczkowa jest szczególnie związana z receptorami AMPA, chociaż wraz z postępem padaczki ważne stają się receptory NMDA.
Czy glutaminian jest dobry? Czy glutaminian jest zły?
Zwykle, gdy czyta się tego typu tekst, kończy się humanizacją cząsteczek, umieszczając na nich etykiety jako „dobre” lub „złe” – to ma nazwę i jest nazywane antropomorfizm, bardzo modny powrót w średniowieczu. Rzeczywistość jest dość daleka od tych uproszczonych osądów.
W społeczeństwie, w którym stworzyliśmy pojęcie „zdrowia”, łatwo jest nam niepokoić niektóre mechanizmy natury. Problem w tym, że natura nie rozumie „zdrowia”. Stworzyliśmy to poprzez medycynę, przemysł farmaceutyczny i psychologię. Jest to koncepcja społeczna i jak wszystkie koncepcje społeczne podlega postępowi społeczeństw, czy to ludzkiej, czy naukowej. Postępy pokazują, że glutaminian wiąże się z wieloma patologiami jak choroba Alzheimera lub Schizofrenia. To nie jest złe oko ewolucji dla człowieka, jest to raczej biochemiczne niedopasowanie koncepcji, której natura wciąż nie rozumie: społeczeństwo ludzkie w XXI wieku.
I jak zawsze, po co to studiować? Myślę, że w tym przypadku odpowiedź jest bardzo jasna. Ze względu na rolę, jaką glutaminian odgrywa w różnych patologiach neurodegeneracyjnych, skutkuje ważnym - choć również złożonym - celem farmakologicznym. Kilka przykładów tych chorób, chociaż nie mówiliśmy o nich w tym przeglądzie, ponieważ uważam że wpis można by napisać wyłącznie na ten temat, są choroba Alzheimera i Schizofrenia. Subiektywnie znajduję poszukiwanie nowych leków dla drugs schizofrenii z dwóch głównych powodów: rozpowszechnienia tej choroby oraz kosztów opieki zdrowotnej nosi; oraz niekorzystne skutki obecnych leków przeciwpsychotycznych, które w wielu przypadkach utrudniają przestrzeganie terapii.
Tekst poprawiony i zredagowany przez Frederica Muniente Peix
Odniesienia bibliograficzne:
Książki:
- Siegel, G. (2006). Podstawowa neurochemia. Amsterdam: Elsevier.
Artykuły:
- Citri, A. & Malenka, R. (2007). Plastyczność synaptyczna: wiele form, funkcji i mechanizmów. Neuropsychofarmakologia, 33 (1), 18-41. http://dx.doi.org/10.1038/sj.npp.1301559
- Hardingham, G. & Bading, H. (2010). Sygnalizacja synaptyczna a pozasynaptyczna receptora NMDA: implikacje dla zaburzeń neurodegeneracyjnych. Nature Reviews Neuroscience, 11 (10), 682-696. http://dx.doi.org/10.1038/nrn2911
- Hardingham, G. & Bading, H. (2010). Sygnalizacja synaptyczna a pozasynaptyczna receptora NMDA: implikacje dla zaburzeń neurodegeneracyjnych. Nature Reviews Neuroscience, 11 (10), 682-696. http://dx.doi.org/10.1038/nrn2911
- Kerchner, G. & Nicoll, R. (2008). Nieme synapsy i pojawienie się mechanizmu postsynaptycznego dla LTP. Nature Reviews Neuroscience, 9 (11), 813-825. http://dx.doi.org/10.1038/nrn2501
- Papuin, T. & Oliet, S. (2014). Organizacja, kontrola i funkcja pozasynaptycznych receptorów NMDA. Philosophical Transactions Of The Royal Society B: Biological Sciences, 369 (1654), 20130601-20130601. http://dx.doi.org/10.1098/rstb.2013.0601