Geometria MOLEKULARNA: definicja i przykłady
trójwymiarowy kształt w którym ułożone są atomy tworzące cząsteczkę, znany jest pod nazwą geometria molekularna lub struktura molekularna.
Geometrię tych cząsteczek można wywnioskować z modelu teoretycznego: model odpychania par elektronów powłoki walencyjnej (RPECV). Model ten jest szczególnie przydatny do przedstawiania geometrii cząsteczek składających się z małych atomów i połączonych ze sobą wiązaniami kowalencyjnymi (współdzielenie elektronów).
W tej lekcji od NAUCZYCIELA odkryjemy definicja geometrii molekularnej i przykłady Aby w ten sposób dowiedzieć się, z czego składa się model RPECV, jak można wydedukować geometrię cząsteczek tą metodą i kilka przykładów.
Indeks
- Definicja geometrii molekularnej
- Przykłady geometrii molekularnej
- Poznaj strukturę Lewisa cząsteczki
- Model odpychania par elektronów powłoki walencyjnej (RPECV)
Definicja geometrii molekularnej.
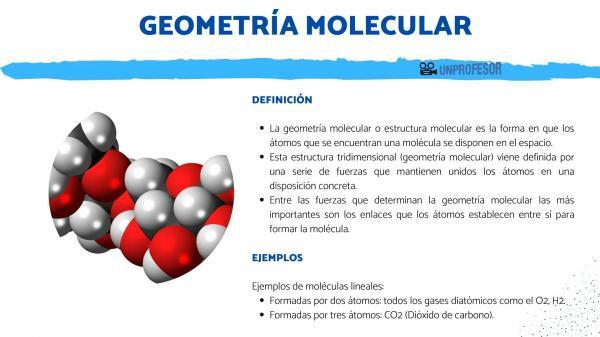
Geometria lub struktura molekularna to sposób atomów znalazłem cząsteczkę są rozmieszczone w przestrzeni.
Ta trójwymiarowa struktura (geometria molekularna) pochodzi zdefiniowany przez szereg sił które utrzymują atomy razem w określonym układzie. Wśród sił determinujących geometrię molekularną najważniejsze są: połączenia że atomy położyć się do siebie, aby tworzą cząsteczkę.
Bardzo ważna jest geometria cząsteczek ponieważ określa, jakie są właściwości fizykochemiczne materii. Na przykład: cząsteczki H2O mają geometrię kątową, którą nadają wiązania, które ją tworzą. Przyjęcie tej ustawionej pod kątem geometrii sprawia, że cząsteczka wody jest dipolem elektrycznym i ma wyjątkowe właściwości. Dzięki swojej geometrii woda w temperaturze pokojowej jest ciekła, jest zdolna do rozpuszczania wielu substancji itp.
Oczywiście, biorąc pod uwagę wielkość cząsteczek, ich geometrii nie można zaobserwować bezpośrednio i należy ją wywnioskować metodami pośrednimi. Ponadto konieczne jest przedstawienie tych geometrii za pomocą modeli teoretycznych.
To właśnie te teoretyczne modele pozwalają nam określić, jaka jest geometria cząsteczki na podstawie jej wzoru cząsteczkowego.
Przykłady geometrii molekularnej.
Jak widzieliśmy w poprzedniej sekcji, atomy tworzące cząsteczkę mogą przybierać różne układy przestrzenne (geometrie). W tej sekcji zobaczymy kilka przykładów geometrii molekularnej.
Geometrie dwuwymiarowe
W niektórych przypadkach cząsteczki uzyskują płaską lub dwuwymiarową geometrię, to znaczy są strukturami, które mają tylko dwa wymiary i zajmują powierzchnię (nie mają objętości).
Geometria liniowa
Jest to najprostsza geometria, dotyczy cząsteczek, których atomy łączą się w linię prostą. Wszystkie cząsteczki składające się z dwóch atomów są liniowe, ale ta geometria występuje również w cząsteczkach składających się z trzech atomów.
Przykłady cząsteczek liniowych:
Tworzą dwa atomy: wszystkie gazy dwuatomowe, takie jak O2, H2.
Składa się z trzech atomów: CO2 (dwutlenek węgla).
Geometria kątowa
Są to cząsteczki składające się z trzech atomów, które łączą się pod kątem. Amplituda utworzonego kąta może być różna, w zależności od rodzaju tworzących go atomów. Amplitudy kątów tworzonych przez cząsteczki kątowe mają wartości od 90º do 120º.
Przykłady: H2O, SO2 (dwutlenek siarki), SnCl2 (dichlorek cyny)
Trójkątna geometria
Są to cząsteczki składające się z czterech atomów, przy czym jeden atom znajduje się w środku wyimaginowanego trójkąta, a pozostałe trzy atomy znajdują się w każdym z wierzchołków tego trójkąta.
Przykłady: SO3 (trójtlenek siarki), NO3- (jon azotanowy)
Geometria kwadratowa
Cząsteczki o tej geometrii mają 5 atomów. Jeden znajduje się w środku kwadratu, a drugi 4 w każdym z wierzchołków figury.
Przykłady: XeF4 (trójfluorek ksenonu)
Geometrie trójwymiarowe
Mają trzy wymiary, to znaczy mają objętość. Geometria cząsteczek 3D jest bardzo zróżnicowana, tutaj zobaczymy tylko kilka przykładów.
Geometria czworościenna
Ta geometria to ta, którą prezentują niektóre cząsteczki utworzone przez pięć atomów, w niej atom znajduje się w środek wyimaginowanego sześcianu i cztery pozostałe atomy znajdują się na wierzchołkach sześcianu (czworościan).
Przykład: CH4 (metan), MnO4-(jon nadmanganianowy)
Trygonalna geometria piramidalna
Są to cząsteczki z czterema atomami ułożonymi na czterech wierzchołkach piramidy o trójkątnej podstawie.
Przykład: NH3 (amoniak), PH3 (fosfina)
Kwadratowa geometria piramidalna pyramid
W tym przypadku liczba atomów tworzących cząsteczkę wynosi sześć, a pięć z nich jest ułożonych w wierzchołki piramidy o podstawie kwadratu, przy czym szósty zajmuje środek kwadratu baza.
Przykład: ClF5 (pentafluorek chloru)
Poznaj strukturę Lewisa cząsteczki.
Zanim będziesz mógł użyć Metoda RPECV trzeba wiedzieć, co to jest Struktura Lewisa cząsteczki i do tego musisz najpierw wiedzieć, co elektroniczna Konfiguracjaz warstwy Walencji różnych atomów tworzących cząsteczkę.
Dlatego zanim będziemy w stanie określić geometrię cząsteczki, konieczne jest wykonanie kilku wcześniejszych kroków:
- DO. Uzyskaj konfiguracje elektronów różnych atomów tworzących cząsteczkę.
- B. Wyznacz liczbę elektronów powłoki walencyjnej każdego z atomów. Elektrony w powłoce walencyjnej to elektrony, które atom może wykorzystać do utworzenia wiązań.
- DO. Wydedukuj strukturę Lewisa biorąc pod uwagę, ile elektronów ma każdy atom w swojej powłoce walencyjnej.
Obraz: odtwarzacz slajdów
Model odpychania par elektronów powłoki walencyjnej (RPECV)
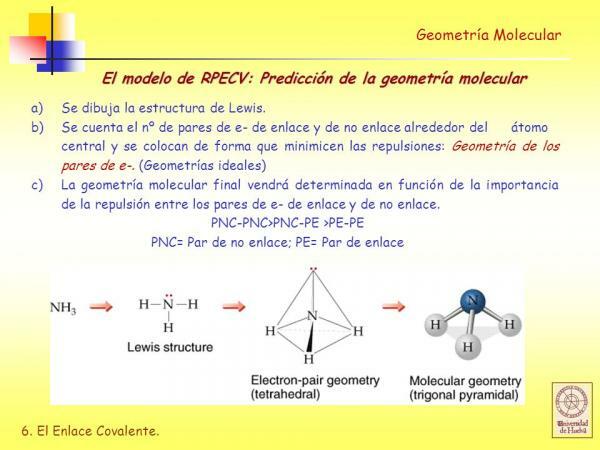
w Struktury Lewisa każdy z połączonych atomów musi spełniać reguła oktetu. Kiedy atom spełnia regułę oktetu, jest otoczony czterema parami elektronów, które mogą być elektronami będącymi częścią wiązanie (wiążące pary elektronów) lub pary elektronów, które nie uczestniczą w tworzeniu wiązania (niewiążące pary elektronów) wiążący).
Jak zobaczymy, po określeniu struktury Lewisa cząsteczki wydedukuj jej geometria przy użyciu modelu odpychania par elektronów powłoki walencyjnej jest bardzo łatwo.
Zgodnie z tym modelem reprezentacji ligandy (X) i niewiążące pary elektronów (E) są rozmieszczone wokół centralnego atomu (A), tak aby odległość między nimi była maksymalna. Suma ligandów i niewiążących par elektronów (X + E) określa typ geometrii cząsteczki.
X + E = 2
Geometria liniowa
AX2: Cząsteczka utworzona przez dwa atomy ligandu przyłączone do centralnego atomu
Przykład: wodorek berylu (BeH2).
X + E = 3
Geometria płaszczyzny trójkątnej (trójkąt równoboczny)
AX3: Cząsteczka składająca się z trzech atomów przyłączonych do centralnego atomu
Przykłady: niektóre chlorki, takie jak bor lub glin (BCl3, AlCl3)
Geometria kątowa (kąt 120º)
AX2E: Cząsteczka z centralnym atomem przyłączonym do dwóch ligandów i niewiążącą parą elektronów.
Przykłady: Chlorek cyny (II) (Sn2Cl)
X + E = 4
Geometria czworościenna
AX4: Cząsteczki z centralnym atomem z czterema ligandami ułożonymi w wiązania tak, że ligandy są mają na wierzchołkach przeciwległych przekątnych sześcian, którego środkiem jest sam centralny atom.
Przykłady: Cząsteczki takie jak metan (CH4), chlorek krzemu (SiCl4) lub tetrachlorek węgla (CCl4) przedstawiają tę geometrię.
Geometria piramidy trygonalnej
AX3E: Cząsteczki z 3 ligandami i 1 samotną parą elektronów, w której ułożone są atomy trzech ligandów podstawa piramidy o podstawie trójkątnej, w której centralny atom znajduje się w górnym wierzchołku wspomnianego piramida
Przykłady: jedną z cząsteczek o takiej geometrii jest amoniak (NH3).
Geometria kątowa (kąt 109º)
AX2E2: Dwa ligandy i centralny atom są ułożone pod kątem 109º
Przykłady: Woda (H2O) jest jedną z cząsteczek o takiej geometrii.
soleometria liniowa
AX3: Ponieważ do centralnego atomu dołączony jest tylko jeden ligand, geometria jest liniowa.
Przykład: fluorowodór lub kwas fluorowodorowy (HF).
X + E = 5
Trygonalna geometria dwupiramidowa
AX5: Cząsteczka ma geometrię dwóch przeciwstawnych piramid, z trójkątną podstawą wspólną dla obu. Centralny atom znajduje się w środku, a ligandy znajdują się na wierzchołkach.
Przykład: pięciochlorek fosforu (PCl5)
Geometria Dyzenoidalna
AX4E: W tego typu geometrii atomy przybierają układ przypominający budowę huśtawki na huśtawce.
Przykład: fluorek tetrasiarkowy (SF4).
Geometria T
AX3E2: Cząsteczki mają kształt litery T, z ligandami na końcach litery i centralnym atomem w miejscu, w którym spotykają się dwie linie, które ją tworzą.
Przykład: trifluorek chloru (ClF3)
Geometria liniowa
AX2E3: W tym przypadku trzy atomy cząsteczki są ułożone w jednej linii z centralnym atomem w pozycji pośredniej.
Przykład: difluorek ksenonu (F2Xe)
X + E = 6
Geometria ośmiościenna
AX6: Ten typ cząsteczki ma strukturę przypominającą ośmiościan, w którym centralny atom zajmowałby środek figury geometrycznej i sześć ligandów w każdym z jej wierzchołków.
Przykład: sześciofluorek siarki (SF6)
Kwadratowa piramida podstawowa
AX5E: W tym przypadku atomy tworzą figurę, w której centralny atom zajmuje środek podstawy, a ligandy pięć wierzchołków figury.
Przykład: pięciofluorek bromu (BrF5)
Płaska geometria kwadratowa
AX4E2: Atomy przybierają układ w kształcie kwadratu, w którym centralny atom zajmuje środek figury, a ligandy każdy z jej wierzchołków.
Przykład: jon czterofluorkowy ksenonu (XeF4)

Jeśli chcesz przeczytać więcej artykułów podobnych do Geometria molekularna: definicja i przykłady, zalecamy wpisanie naszej kategorii Atom.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Angel Vázquez Segura. (2018) Chemia podstawowa. Madryt: Uned