Protony, neutrony i elektrony
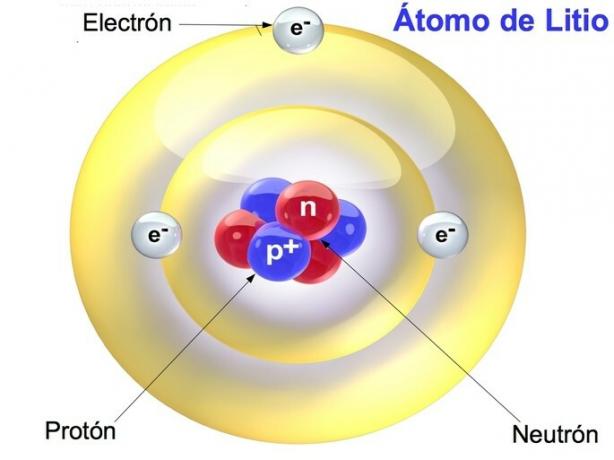
Protony, neutrony i elektrony to cząstki tworzące atom, który jest najmniejszą częścią pierwiastka. Cząstki te określają cechy i właściwości pierwiastków chemicznych.
Protony i neutrony są skoncentrowane w jądrze atomowym, podczas gdy elektrony są rozmieszczone w skorupie lub obrzeżu atomu. Atom ma taką samą liczbę elektronów i protonów, natomiast liczba neutronów jest zmienna.
Następnie przedstawiamy tabelę porównawczą protonów, neutronów i elektronów.
| Proton | Neutron | Elektron | |
|---|---|---|---|
| Definicja | Cząstka subatomowa o ładunku dodatnim | Subatomowe cząsteczki ładunku neutralnego | Ujemnie naładowana cząstka subatomowa |
| Załaduj | Pozytywny +1 |
Neutralny 0 |
Negatywny -1 |
| Symbol | p+ | nie0 | i- |
| Lokalizacja w atomie | Rdzeń | Rdzeń | Orbitale peryferyjne |
| Masa (kg) | 1673 x 10--27kg | 1675 x 10--27kg | 9109 x 10-31kg |
| Masa w porównaniu do protonu (amu) | 1 | 1 | 0,0005 |
| Cząstka elementarna | 3 kwarki: 2 u i 1 d | 3 kwarki: 2 d i 1 u | 1 lepton |
| Odkrywca (rok) | I. Rutherforda (1911) | JOT. Chadwick (1931) | JJ Thomson (1897) |
Co to jest proton?
Protony to dodatnio naładowane cząstki znajdujące się w jądrze atomu. Każdy atom pierwiastka ma ustaloną liczbę protonów, która określa jego liczbę atomową, czyli Z. Zatem wodór ma proton, a Z równa się 1.
Masa protonu wynosi 1,673 x 10-27 kg, co oznacza 1 jednostkę masy atomowej lub amu (dla jego akronimu w języku angielskim jednostka masy atomowej).
W 1911 roku Ernest Rutherford odkrył, że jądro atomu jest małe i naładowane dodatnio, stąd koncepcja protonu.
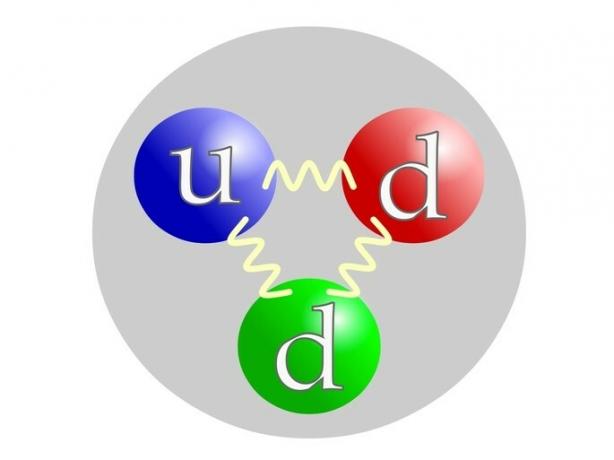
Proton składa się z cząstek elementarnych zwanych kwarkami lub kwarki: 2 kwarki u (per w górę= góra) i 1 kwark d (by na dół= dół).

Jak obliczyć protony atomu?
Liczbę protonów w atomie można określić na podstawie jego liczby atomowej, która jest numerem pozycji w układzie okresowym pierwiastków.
Na przykład złoto Au ma liczbę atomową = 79, co oznacza, że złoto ma 79 protonów w swoim jądrze.
Czym jest neutron?
Neutrony to cząstki znajdujące się w jądrze atomu wraz z protonami. Są oznaczone literą nie i są naładowane neutralnie. Jedynym pierwiastkiem, który nie ma neutronów, jest wodór.
Masa neutronów jest bardzo podobna do masy protonów, więc suma mas protonów i neutronów określa masę atomową pierwiastka.
Atomy o tej samej liczbie atomowej, ale różnej liczbie neutronów nazywane są izotopami. Na przykład deuter jest izotopem wodoru, który ma neutron i proton w jądrze.
Angielski fizyk James Chadwick odkrył tę cząstkę subatomową w 1931 roku, o masie zbliżonej do protonu, ale o neutralnym ładunku elektrycznym, dlatego nazwano ją neutronem.
Neutron składa się jak proton z kwarków: 1 kwark u (by w górę= góra) i 2 kwarty d (by na dół= dół).
Jak obliczyć neutrony atomu?
Możemy obliczyć liczbę neutronów w atomie, jeśli znamy jego masę atomową i liczbę atomową Z. Wiemy już, że liczba atomowa Z to liczba protonów, a masa atomowa to suma protonów i neutronów, które posiada atom.
Na przykład tlen ma masę atomową 16, a Z wynosi 8. Liczba protonów w tlenie równa się masie atomowej minus Z:
16 - 8 = 8 neutronów
Czym jest elektron?
Elektrony to cząstki atomu znajdujące się w chmurze otaczającej jądro. Podczas gdy protony i neutrony są skoncentrowane w jądrze, elektrony są rozmieszczone warstwami na zewnątrz.
Elektrony w zewnętrznej powłoce atomu mogą przeskakiwać z jednego atomu na drugi. Daje to atomowi inny ładunek elektryczny; na przykład, jeśli atom zyska elektron, jego ładunek będzie ujemny, a jeśli straci elektron, ładunek będzie dodatni.
Tak dzieje się w jonach, czyli atomie, który zyskuje lub traci jeden lub więcej elektronów. Na przykład chlor ma 17 elektronów, ale może zyskać jeden elektron, aby stać się anionem chlorku Cl.-, z 18 elektronami i ładunkiem ujemnym.
Elektron został odkryty w 1897 roku przez J.J. Thomson, to samo z atomowym modelem „budyniu z rodzynek”.
Elektron składa się z cząstki elementarnej, jaką jest lepton.
Masa elektronu jest prawie 2000 razy mniejsza niż masa protonu i neutronu. Załóżmy, że proton lub neutron miałby wielkość 10-funtowej kuli do kręgli, a elektron byłby wielkości małej kulki.
Dlatego masa elektronów w atomie jest pomijalna przy obliczaniu masy atomowej.
Jak obliczyć elektrony atomu?
Liczba elektronów w obojętnym atomie jest równa liczbie protonów w tym atomie. Na przykład złoto Au ma 79 protonów, więc będzie miało 79 elektronów.
Możesz być również zainteresowany zobaczeniem:
- Kationy i aniony
- Atomy i cząsteczki.
Bibliografia
Myers, RL (2005) Podstawy fizyki. Greenwood.
Peake, B.M. (1989) Odkrycie elektronu, protonu i neutronu. J. Chemical Education 66: 738. DOI: 10.1021 / ed066p738