Charakterystyka kwasów i zasad: główne różnice
Charakterystyki kwasów i zasad to wszystkie te właściwości i cechy, dzięki którym możemy odróżnić kwas od zasady.
Zgodnie z teorią Arrehniusa a kwas jest substancją uwalniającą protony H+ po rozpuszczeniu w wodzie oraz baza to każda substancja, która uwalnia jony hydroksylowe OH- w roztworze wodnym.
| Kwasy | Bazy | |
|---|---|---|
| Tworzenie jonów | Teraźniejszość | Teraźniejszość |
| Reakcja neutralizacji | Kiedy reaguje z bazą. | Kiedy reaguje z kwasem. |
| Rozpuszczalność w wodzie | Rozpuszczalny | Częściowo rozpuszczalny. Wodorotlenki wapnia, baru i glinu są słabo rozpuszczalne. |
| Przewodność elektryczna | Teraźniejszość | Teraźniejszość |
| Stan skupienia | Stały, płynny lub gazowy | Stały, płynny lub gazowy |
| Reakcja z papierkiem lakmusowym | Czerwona kolorystyka | Niebieska kolorystyka |
| wartość PH | Poniżej 7 | Większe niż 7 |
| odpowiednik sprzężony | Słaby kwas tworzy sprzężoną zasadę. | Słaba zasada tworzy sprzężony kwas. |
| Działanie żrące | Silne kwasy | Mocne podstawy |
Charakterystyka kwasów
Kwasy mają kilka cech, dzięki którym można je zidentyfikować.
Zdolność do tworzenia jonów z kwasów
Główną cechą substancji kwasowych jest to, że mogą ulegać jonizacji, czyli tracić lub uzyskiwać elektrony.
Kwas solny HCl, silny kwas, jonizuje się tworząc anion chlorkowy Cl- i proton H+.
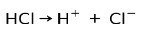
Reakcja neutralizacji
Kwas reaguje z zasadą, tworząc sól i wodę. Ta reakcja jest znana jako Reakcja neutralizacji. Na przykład HCl reaguje z NaOH, tworząc chlorek sodu NaCl (sól kuchenna) i wodę:
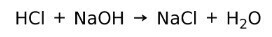
Rozpuszczalność kwasów w wodzie
Kwasy są na ogół rozpuszczalne w wodzie. Na przykład kwas solny lub kwas solny jest umiarkowanie rozpuszczalny w wodzie, do 82 g HCl można rozpuścić w 100 ml wody w temperaturze 0ºC. W przypadku kwasu siarkowego H2południowy zachód4, mieszanina z wodą wytwarza ciepło, dlatego zawsze zaleca się dodanie kwasu do wody, aby uniknąć eksplozji.
Siła kwasu
To, jak kwasy dysocjują, określa, czy są one silne, czy słabe. Siła kwasu jest podana przez jego stała dysocjacji.
Kwas azotowy HNO3 to jest mocny kwas ponieważ w roztworze wodnym całkowicie jonizuje się do protonów i jonów azotanowych:

Oznacza to, że gdy dodamy HNO3 w wodzie analizując wodę znajdziemy tylko H+ jony azotanowe i praktycznie brak HNO3.
Zamiast tego kwas octowy znajdujący się w occie jest słaby kwas, ponieważ tylko część jest zdysocjowana:
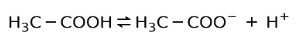
Dlatego jest reprezentowany strzałkami w dwóch kierunkach, oznacza to, że w roztworze wodnym będziemy mieli kwas octowy, H+ i anion octanowy (H3C-COO-).
Stany skupienia kwasów
Kwasy można znaleźć w stanie ciekłym, stałym lub gazowym. Na przykład kwas solny HCl jest cieczą, siarkowodór HS jest gazem, a kwas szczawiowy jest ciałem stałym.
Reakcja z papierkiem lakmusowym z kwasów

Kiedy umieścimy pasek papierka lakmusowego w kwaśnej substancji, papierek lakmusowy zmieni kolor na czerwony.
Identyfikacja kwasów po ich pH
PH jest miarą ilości H+ obecny w roztworze. Tak więc między pH 0 a 7 znajdujemy się w obecności kwasu. Na przykład ocet ma pH równe 2, pH kwasu siarkowego w akumulatorach samochodowych wynosi 1.
Przewodność elektryczna kwasów
Ponieważ kwasy mogą dysocjować i wytwarzać jony naładowane elektrycznie, kwaśne roztwory mogą przewodzić prąd. Na przykład w akumulatorach samochodowych jako przewodnik prądu elektrycznego wykorzystywany jest kwas siarkowy, który jest silnym kwasem.
Korodujące działanie silnych kwasów
Silne kwasy działają żrąco, mogą palić tkanki organiczne, dlatego należy obchodzić się z nimi wyjątkowo ostrożnie.
Słabe kwasy tworzą sprzężony odpowiednik
Po rozpuszczeniu słabe kwasy tworzą tak zwaną parę sprzężoną, to znaczy słaby kwas tworzy sprzężoną zasadę.
Na przykład:

W tym przypadku kwas mrówkowy lub metanowy (HCOOH), po zdysocjowaniu, tworzy postać sprzężonego jonu zasadowego.
Może Cię zainteresować:
- Silne i słabe kwasy i zasady.
- Przykłady kwasów i zasad.
Charakterystyka baz
Następnie przedstawiamy właściwości zasad lub roztworów alkalicznych, które je charakteryzują.
Podstawowa zdolność jonizacji
Substancje zasadowe lub alkaliczne charakteryzują się tworzeniem jonów po rozpuszczeniu w wodzie:

W tym przypadku wodorotlenek sodu NaOH ulega jonizacji, tworząc anion wodorotlenkowy OH- i kation sodu Na+.
Zasada reaguje z kwasem, tworząc sól
Zasada reaguje z kwasem w reakcji neutralizacji, tworząc wodę i sól, na przykład:

W tym przypadku wodorotlenek glinu Al (OH)3, zasada, reaguje z HCl i tworzy chlorek glinu AlCl3 i woda. Wodorotlenek glinu jest stosowany jako środek zobojętniający kwas w celu złagodzenia refluksu żołądkowego poprzez neutralizację kwasu wytwarzanego przez żołądek.
Bazuje na rozpuszczalności w wodzie
Niektóre zasady są rozpuszczalne w wodzie. Wodorotlenki ziem alkalicznych, takie jak wodorotlenek wapnia i wodorotlenek baru, są słabo rozpuszczalne w wodzie. Na przykład wodorotlenek sodu lub sodę kaustyczną można rozpuścić 109 g w 100 ml wody o temperaturze 20ºC. Podczas gdy wodorotlenek magnezu lub mleko magnezowe Mg (OH)2 jest praktycznie nierozpuszczalny w wodzie.
Siła podstawowa
W zależności od stopnia jonizacji zasady mogą być silne lub słabe. Na przykład wodorotlenek litu jest silna baza ponieważ w roztworze wodnym całkowicie jonizuje się do jonów wodorotlenowych OH i kationów litu Li+:
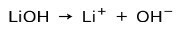
Z drugiej strony amoniak NH3 jest słaba podstawa ponieważ w kontakcie z wodą nie cały amoniak dysocjuje:
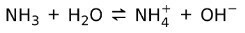
Stan Materii Baz
Zasady można znaleźć w stanie stałym, ciekłym i gazowym. Na przykład czysty wodorotlenek sodu jest w stanie stałym, amoniak jest gazem.
Reakcja z papierkiem lakmusowym podstaw
Gdy pasek papierka lakmusowego umieścimy w substancji alkalicznej, papierek zmieni kolor na niebieski.
Identyfikacja zasad według ich pH
Zasady charakteryzują się tym, że mają pH między 7 a 14.
 Przewodność elektryczna podstaw
Przewodność elektryczna podstaw
Zasady ze względu na swoją zdolność jonizacyjną są dobrymi przewodnikami prądu. Na przykład w bateriach alkalicznych jako przewodnik elektryczny stosuje się wodorotlenek potasu KOH.
Działanie korozyjne baz
Silne zasady mogą uszkadzać tkanki organiczne. Na przykład środki do czyszczenia piekarników kuchennych są na ogół mocnymi zasadami i zawsze zaleca się obchodzenie się z nimi z najwyższą ostrożnością, noszenie rękawiczek i ochronę oczu.
Słabe zasady tworzą sprzężony odpowiednik
Słabe zasady po rozpuszczeniu tworzą sprzężony odpowiednik, to znaczy słaba zasada tworzy sprzężony kwas.
Na przykład tris-(hydroksymetylo)aminometan (OHCH2)3CNH2 jest słabą zasadą, której sprzężonym kwasem jest (OHCH2)3CNH3+:
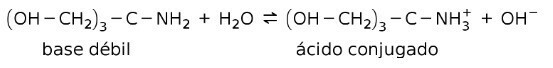
Jest to podstawa działania substancji buforowych lub bufor, które są substancjami używanymi do stałego utrzymywania pH roztworów.
Możesz być zainteresowany poznaniem różnic między:
- Kwasy i zasady.
- Kationy i aniony