Evolução da TABELA PERIÓDICA: desde a sua criação até hoje
A tabela periódica é uma das ícones mais icônicos da ciência. Embora 2019 tenha sido o 150º aniversário de sua criação, não é de forma alguma um documento acabado. Nesta lição de um PROFESSOR, veremos o que evolução da tabela periódica desde sua criação até os dias atuais e que avanços no conhecimento dos átomos e suas propriedades o tornaram possível.
Índice
- Qual é a tabela periódica?
- Primeira tabela periódica: a origem
- História da tabela periódica e evolução
Qual é a tabela periódica?
O tabela periódica O sistema periódico de elementos é o documento científico que concentra mais informações em menos espaço e constitui um dos ícones mais poderosos da ciência. Ele contém uma boa parte do conhecimento que temos sobre química. Não existe documento semelhante em qualquer outra disciplina científica.
A tabela periódica dos elementos é um sistema de classificação de elementos químicos Tudo começou há mais de 200 anos. Este sistema de classificação vem crescendo e mudando ao longo do tempo, conforme a ciência progrediu e novos foram descobertos.
elementos químicos. No entanto, as várias modificações foram incorporadas mantendo sua estrutura fundamental intacta.A tabela periódica tem esse nome porque expressa graficamente a maneira como eles se repetem em intervalos regulares, certos propriedades quimicas. É um tipo de representação bidimensional ou, em suas representações mais modernas, tridimensional.
No tabela periódica clássica (bidimensional) os elementos químicos são organizados em grupos ou famílias e são representados na tabela periódica atual em colunas verticais. A disposição ordenada desses grupos em colunas dá origem a uma série de linhas, chamadas de períodos, onde os elementos são ordenados de acordo com seu peso atômico. A tabela periódica consiste em sete períodos de duração variável.

Primeira tabela periódica: a origem.
Antes de Mendeleev, outros cientistas desenvolveram sistemas de classificação para elementos químicos. Mas, ao contrário da tabela periódica dos elementos, eles eram meras listas dos elementos conhecidos; enquanto a tabela periódica tem a particularidade de ser um sistema de classificação em duas dimensões (linhas e colunas) ou tridimensionais, em suas versões mais modernas, onde os elementos químicos são dispostos em sucessivas camadas.
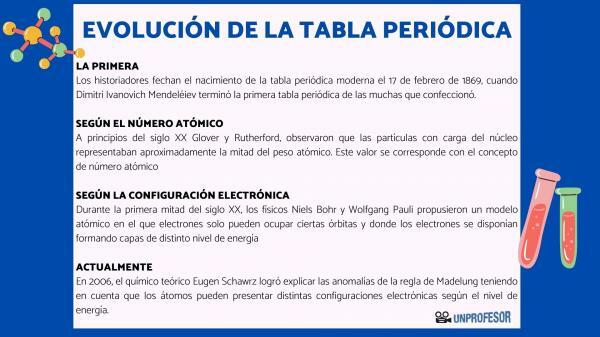
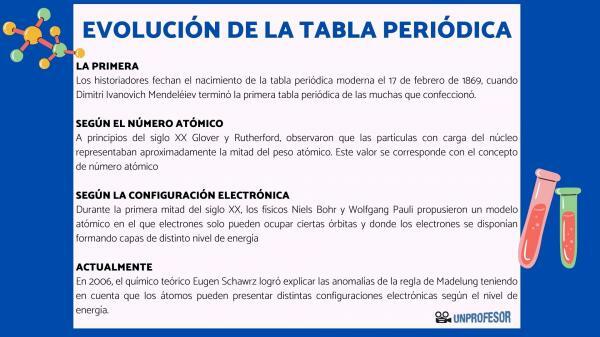
Por esta razão, os historiadores datam o nascimento da tabela periódica moderna para 17 de fevereiro de 1869, quando Dimitri Ivanovich Mendeleev termine o primeira tabela periódica dos muitos que ele fez. Esta tabela consistia em 63 elementos organizados em famílias e deixava espaços vazios para os elementos ainda não descobertos, mas dos quais ele deduziu seu peso atômico (como no caso do Gálio, Germânio e Escândio)
O principal dado para a descoberta da tabela periódica foi o conhecimento prévio da peso atômico de cada elemento.
O que é peso atômico e número atômico?
Este número representou o peso do átomo e era o único valor mensurável do átomos. Mas não foi em nenhum caso de medições diretas (não existem dispositivos de medição que permitam pesar átomos isolados), mas sim um sistema que estabeleceu um padrão em que um valor arbitrário de 1 foi dado ao átomo de hidrogênio e o valor do peso atômico dos elementos restantes foi calculado em relação a este Padrão.
Os primeiros cálculos do número atômico dos elementos foram realizados pelo químico inglês John Dalton, e gerou um grande debate científico durante a primeira metade do século XIX. Porém, na segunda metade do século XIX, já existia um notável consenso sobre o sistema de cálculo dos pesos atômicos dos elementos. O peso atômico passou a ser, a partir de Mendeleev, um critério fundamental para a correta ordenação dos elementos da tabela periódica.
Quando Mendeleev ordenou os elementos conhecidos de acordo com seus aumentando o peso atômico, observaram o surgimento de propriedades recorrentes que permitiam que os elementos fossem agrupados em grupos ou famílias de elementos semelhantes entre si. No entanto, em alguns casos, a ordenação dos elementos de acordo com seu peso atômico não respondeu às semelhanças entre os elementos que foram observados e Mendeleev mudou a posição de 17 elementos no arranjo da tabela periódica apesar de seus pesos atômicos, para poder agrupá-los com aqueles elementos com os quais apresentavam analogias.
Essas mudanças mostraram que alguns dos pesos atômicos aceitos não estavam corretos e foram recalculados. Apesar das correções nos pesos atômicos, ainda havia elementos que precisavam ser colocados em posições diferentes das indicadas por seus pesos atômicos.

Imagem: BBC.com
História da tabela periódica e evolução.
Apesar da indiscutível contribuição de Mendeleev, a tabela periódica dos elementos não é fruto do trabalho de um único pesquisador. Além de Mendeleiev, durante a segunda metade do século XIX e ao longo do século XX muitos Químicos continuaram investigando a melhor forma de organizar informações sobre elementos químicos conhecido. Ainda mais considerando que durante este tempo a descoberta de novos elementos químicos ou substâncias simples, graças à espectrometria (que estuda as interações entre os átomos e a radiação eletromagnética).
O classificação de elementos na tabela periódica foi inicialmente baseada nos cálculos incipientes do pesos atômicos dos elementos e analogias reveladas que permitiram que os elementos fossem agrupados em famílias análogas. Mesmo assim, o motivo do aparecimento dessas propriedades periódicas não pôde ser explicado. Foi ao longo do século XX, com a descoberta da estrutura eletrônica, que se compreendeu o porquê dessa periodicidade nas propriedades dos elementos.
O número atômico como uma ordem de classificação
No início do século 20 Glover e Rutherford, observaram que as partículas carregadas no núcleo representavam cerca de metade do peso atômico. Este valor corresponde ao conceito de número atômico que é definido como o número de prótons no núcleo atômico e que coincide com o número de elétrons em um átomo neutro. Este novo valor justificou as alterações de posicionamento de alguns elementos que até então tinham sido efetuadas. Por exemplo, a mudança de posição entre telúrio e iodo.
Em 1913, Henry Moseley confirmou a ordenação da tabela em função do número atômico por espectrometria de raios-X. A ordenação de acordo com o número atômico ainda está em vigor hoje.
Ao mesmo tempo, durante o século 20, novos elementos químicos continuaram a ser descobertos graças à mecânica quântica e ao desenvolvimento da técnica de bombardeio de átomos por partículas, a partir da segunda metade do século. Com esta nova técnica foi possível criar elementos artificiais que não estão presentes na natureza.
Embora o progresso tenha sido feito no arranjo correto dos elementos dentro da tabela periódica, ainda a razão para a ocorrência recorrente de certas propriedades (as propriedades periódico). O desenvolvimento do mecânica quântica (ramo da física que estuda o comportamento da luz e dos átomos em escala microscópica) a partir de 1920 foi decisiva para explicar o porquê dessas propriedades.
Configuração eletrônica como explicação das propriedades periódicas
Durante a primeira metade do século 20, os físicos Niels Bohr Y Wolfgang Pauli eles propuseram um modelo atômico no qual os elétrons só podem ocupar certas órbitas e onde os elétrons estão dispostos formando camadas de diferentes níveis de energia. A forma como os elétrons são distribuídos nos orbitais nas diferentes camadas ou níveis de energia é conhecida como configuração eletronica.
A descoberta do arranjo dos elétrons nas configurações eletrônicas foi fundamental para o entendimento da periodicidade das propriedades. periódica, uma vez que foi observado que essas propriedades estavam intimamente relacionadas à configuração eletrônica mais externa dos átomos (camada de Valencia).
A ordem em que os elétrons preenchem os orbitais atômicos foi estabelecida em 1930 pelo físico Erwin Madelung, que estabeleceu uma regra numérica para a ordem de preenchimento. Esta regra é conhecida como Regra de Madelung e é uma regra empírica que não poderia ser explicada por meio da mecânica quântica.
A sequência de preenchimento é simples para as três primeiras linhas da tabela periódica, mas no quarta linha, onde os elementos de transição estão localizados, a ordem de enchimento passa por uma série de alterações. Há um total de 20 itens anômalos que não seguem esta regra.
A evolução da mesa continua hoje
Em 2006, o químico teórico Eugen Schawrz Ele conseguiu explicar as anomalias da regra de Madelung levando em consideração que os átomos podem ter diferentes configurações eletrônicas dependendo do nível de energia. Calculando as médias, as configurações eletrônicas da maioria dos elementos obedecem à regra de Madelung.
A tabela periódica continua a ser motivo de debate no século 21, embora o arranjo ou configuração eletrônica do elementos, ainda é válido explicar esse ordenamento e as anomalias observadas nas configurações eletrônicas por meio de um teoria.
Se você quiser ler mais artigos semelhantes a Evolução da tabela periódica - resumo, recomendamos que você insira nossa categoria de O átomo.
Bibliografia
Vários autores. (2019)Especial: a tabela periódica. Pesquisa e ciência. Barcelona: Scientific Press S.A.