TOATE proprietățile ATOMULUI

Imagine: SlideShare
Deși nu suntem în stare să îi vedem cu ochiul liber, atomii fac parte din toată materia a planetei noastre. Toată materia este formată din atomi, care se grupează pentru a forma elemente chimice, molecule, compuși etc. Atomul este definit ca cea mai mică unitate de bază a materiei care are proprietățile unui element chimic. Fiecare element chimic este definit de tipul de atom din care este format, deci întrebarea finală este: ce proprietăți are atomul? În această lecție de la un PROFESOR vom revizui proprietățile atomului care fac din fiecare atom un element chimic caracteristic.
Index
- Ce este atomul?
- Număr atomic, număr de masă și izotopi
- Densitatea, o altă proprietate a atomului
- Raza ionică și raza Vanderwalls
- Energie de ionizare
Ce este atomul?
Înainte de a intra pentru a analiza proprietățile atomului, este important să știm mai bine despre ce este vorba. atom este o unitate formată din trei particule subatomice: protoni, neutroni și electroni. Acestea sunt organizate în nucleu și cortex.
- nucleu Este alcătuit protoni Da neutroni, care se află în centrul atomului și este responsabil pentru cea mai mare parte a greutății atomului; protonii sunt încărcați pozitiv, în timp ce neutronii sunt neutri, astfel încât nucleul este încărcat pozitiv.
- Cortex Este format din electroni, care sunt particule mici, încărcate negativ, care se rotesc în jurul nucleului formând orbite (cum ar fi cea a planetelor), dar fără a cădea vreodată în nucleul atomului. Cortexul atomului este responsabil pentru interacțiunea cu cortexul celorlalți atomi, deoarece este situat în exteriorul atomilor.
Diferitii atomi sunt alcatuiti din protoni, neutroni si electroni, la fel in toate elementele chimice. Deci, ce face diferitele elemente chimice? Numărul de protoni, neutroni și electroni din care sunt compuși atomii fiecărui element este diferit și acest lucru la rândul său face ca fiecare element să aibă diferite Caracteristici sau altele.

Imagine: SlideShare
Numărul atomic, numărul masei și izotopii.
Primele trei caracteristici au legătură directă cu numărul de particule care alcătuiesc atomul fiecărui element.
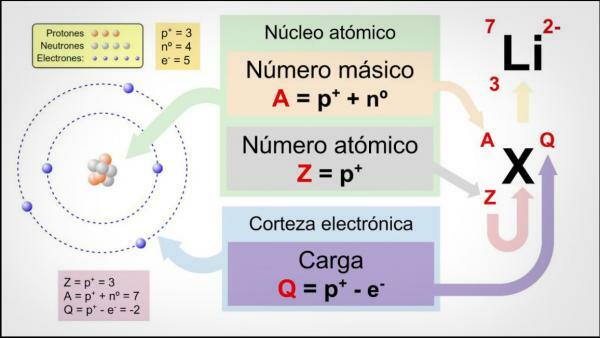
număr atomic (Z) indică numărul de protoni care alcătuiesc nucleul unui atom. De exemplu, toți atomii de fier vor avea 26 de protoni în nucleul lor. În plus, dacă nu ne spun altceva, elementele chimice se află într-o stare neutră, adică sarcina pozitivă (protoni) și negativă (electroni) este aceeași, deci toți vor avea și 26 electroni.
numar de masa sau greutate atomică (A) indică numărul total de protoni și neutroni care alcătuiesc nucleul unui atom. După cum am indicat deja, greutatea electronilor este practic neglijabilă în comparație cu cea a electronilor. protoni și neutroni, deci numărul de masă indică indirect greutatea atomului în cauză. Continuând cu exemplul de fier, dacă consultați tabelul periodic al elementelor veți vedea că greutatea atomica acestui element este 55,85, ceea ce înseamnă că toți atomii acelui element vor avea acest lucru greutate.
În cele din urmă, izotopi ale unui element chimic sunt variante ale aceluiași atom (adică au același număr atomic), dar un număr de masă diferit, adică un număr diferit de neutroni. Majoritatea elementelor chimice au mai mult de un izotop natural, elementul cu cea mai mare cantitate de izotopi stabili fiind Tin (Sn), care are 10 izotopi naturali diferiți.
Imagine: ConceptDefinition.de
Densitatea, o altă proprietate a atomului.
densitate a unui atom este numărul de unități de masă (u.m.a) ale elementului care sunt prezente într-un anumit volum de spațiu. Densitatea oricărei substanțe este simbolizată prin litera greacă „Ro” (scris r) iar unitățile sale conform sistemului internațional de unități (SI) sunt kilograme pe metru cub (kg / m3). În cazul elementelor chimice, fiind atât de mici, gramul pe centimetru cub (g / cm3).
Pentru a calculează densitatea unui atom (densitatea atomică), ar trebui să luăm în considerare masa atomului și volumul acestuia. În timp ce cea mai mare parte a masei atomului se află în nucleul aceluiași, volumul trebuie să facă cu cât de mare este atomul și, prin urmare, numărul orbitalilor electronici va juca un rol important. Luând în considerare aceste proprietăți și tendința lor în sistemul periodic, putem observa că densitatea crește pe măsură ce creștem într-un grup și crește, de asemenea, pe măsură ce ne apropiem de partea centrală din tabelul periodic.
Imagine: YouTube
Raza ionică și raza Vanderwalls.
raza ionică este raza pe care un ion al unui element o are în starea de cristal ionic. În această stare, ionii sunt atât de apropiați încât orbitalii electronici cei mai exteriori sunt în contact unul cu celălalt.
Pe de altă parte, raza vanderwalls Este distanța la care doi atomi sunt ținuți la distanță datorită respingerii sarcinilor negative care există între electronii fiecăruia dintre atomi. Raza Vanderwalls ar fi raza unei sfere solide imaginare folosită pentru modelarea atomului, deci nu este folosită prea mult în practica zilnică.
Spre deosebire de ceea ce se întâmplă cu densitatea sau masa, aceste două proprietăți sunt strâns legate cu volumul atomului, adică au mai mult de-a face cu numărul de electroni din el decât cu nucleu.

Imagine: SlidePlayer
Energie de ionizare.
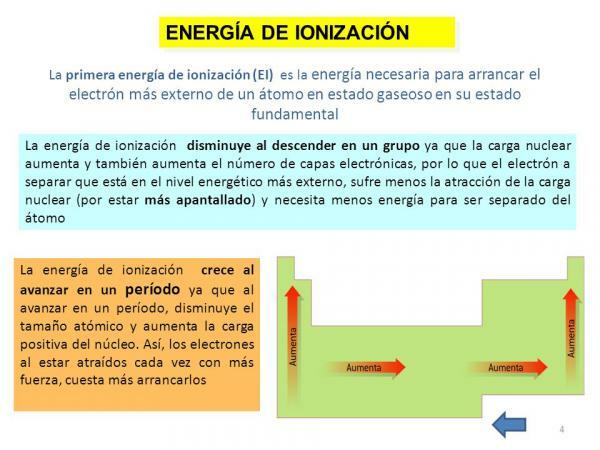
În cele din urmă, o altă proprietate a atomului este energie de ionizare, o proprietate care ne spune energia de care avem nevoie pentru a separa un electron în starea sa de bază (alta decât un anion sau un cation) a unui atom al unui element în stare gazoasă, dar ar putea fi definit și ca forța cu care un electron se leagă de altul molecule. Această proprietate este foarte interesantă, deoarece ne permite să ne facem o idee aproximativă despre capacitatea de a reacționa a unui atom al unui anumit element chimic. Energia de ionizare este mai mare pe măsură ce îndepărtăm electronii, deci pentru un element există o energie de prima ionizare, a doua energie de ionizare, și așa mai departe și devin din ce în ce mai mari.
Ca și în cazul precedent, această proprietate este, de asemenea, strâns legată de numărul de orbitali ai element în cauză deoarece, cu cât are mai puțini orbitali, cu atât va costa mai mult eliminarea electronilor dintr-un atom determinat.
Imagine: SlidePlayer
Dacă doriți să citiți mai multe articole similare cu Proprietățile atomului, vă recomandăm să introduceți categoria noastră de Atomul.