Geometria MOLECULARĂ: definiție și exemple
formă tridimensională în care sunt aranjați atomii care alcătuiesc o moleculă este cunoscut sub numele de geometrie moleculară sau structură moleculară.
Este posibil să se deducă geometria acestor molecule dintr-un model teoretic: modelul de repulsie al perechilor de electroni din carcasa de valență (RPECV). Acest model este util în special pentru a reprezenta geometria moleculelor formate din atomi mici și legate între ele prin legături covalente (partajarea electronilor).
În această lecție de la un PROFESOR vom descoperi definirea geometriei moleculare și exemple Astfel, în acest fel, veți afla în ce constă modelul RPECV, cum poate fi dedusă geometria moleculelor prin această metodă și câteva exemple.
Index
- Definiția molecular geometry
- Exemple de geometrie moleculară
- Cunoașteți structura Lewis a moleculei
- Model de repulsie a perechii de electroni a carcasei de valență (RPECV)
Definiția molecular geometry.
Geometria moleculară sau structura moleculară este felul atomilor a găsit o moleculă sunt dispuse în spațiu.
Această structură tridimensională (geometrie moleculară) vine definită de o serie de forțe care țin atomii împreună într-un aranjament specific. Printre forțele care determină geometria moleculară cele mai importante sunt linkurile că atomi întindeți-vă unul la celălalt să formează molecula.
Geometria moleculelor este foarte importantă deoarece determină care sunt caracteristicile fizico-chimice ale materiei. De exemplu: moleculele H2O au o geometrie unghiulară care este dată de legăturile care o formează. Adoptarea acestei geometrii unghiulare transformă molecula de apă într-un dipol electric și îi conferă proprietăți excepționale. Datorită geometriei sale, apa este lichidă la temperatura camerei, este capabilă să dizolve multe substanțe etc.
Evident, având în vedere dimensiunea moleculelor, geometria lor nu poate fi observată direct și trebuie dedusă prin metode indirecte. Mai mult, este necesar să se reprezinte aceste geometrii prin intermediul modelelor teoretice.
Aceste modele teoretice ne permit să determinăm cum este geometria unei molecule din formula sa moleculară.
Exemple de geometrie moleculară.
După cum am văzut în secțiunea anterioară, atomii care alcătuiesc o moleculă pot dobândi diferite aranjamente spațiale (geometrii). În această secțiune vom vedea câteva exemple de geometrie moleculară.
Geometrii bidimensionale
În unele cazuri, moleculele dobândesc geometrii plane sau bidimensionale, adică sunt structuri care au doar două dimensiuni și ocupă o suprafață (nu au volum).
Geometrie liniară
Este cea mai simplă geometrie, este vorba despre molecule ale căror atomi sunt uniți pentru a forma o linie dreaptă. Toate moleculele formate din doi atomi sunt liniare, dar această geometrie apare și în moleculele formate din trei atomi.
Exemple de molecule liniare:
Format din doi atomi: toate gazele diatomice precum O2, H2.
Alcătuit din trei atomi: CO2 (dioxid de carbon).
Geometrie unghiulară
Sunt molecule formate din trei atomi care se reunesc într-un unghi. Amplitudinea unghiului format poate fi diferită, în funcție de tipul de atomi care îl formează. Amplitudinile unghiurilor formate de moleculele unghiulare au valori cuprinse între 90º și 120º.
Exemple: H2O, SO2 (dioxid de sulf), SnCl2 (diclorură de staniu)
Geometria triunghiulară
Sunt molecule formate din patru atomi, cu un atom situat în centrul unui triunghi imaginar și ceilalți trei atomi rămași situați în fiecare dintre vârfurile acestui triunghi.
Exemple: SO3 (trioxid de sulf), NO3- (ion nitrat)
Geometria pătratului
Moleculele cu această geometrie au 5 atomi. Unul este situat în centrul unui pătrat și celălalt 4 în fiecare dintre vârfurile figurii.
Exemple: XeF4 (trifluorură de xenon)
Geometrii tridimensionale
Au trei dimensiuni, adică au volum. Geometriile moleculelor 3D sunt foarte diverse, aici vom vedea doar câteva exemple.
Geometrie tetraedrică
Această geometrie este cea prezentată de unele molecule formate din cinci atomi, în care se află un atom centrul unui cub imaginar și cei patru atomi rămași sunt situați la vârfurile cubului (tetraedru).
Exemplu: CH4 (metan), MnO4-(ion permanganat)
Geometrie piramidală trigonală
Sunt molecule cu patru atomi dispuși la cele patru vârfuri ale unei piramide cu o bază triunghiulară.
Exemplu: NH3 (amoniac), PH3 (fosfină)
Geometrie piramidală cuadrangulară
În acest caz, numărul atomilor care alcătuiesc molecula este de șase și cinci dintre ei sunt dispuși în vârfurile unei piramide cu o bază pătrată, în timp ce al șaselea ocupă centrul pătratului baza.
Exemplu: ClF5 (pentafluorură de clor)
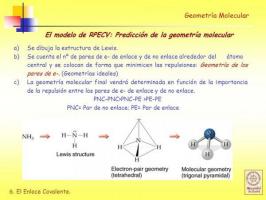
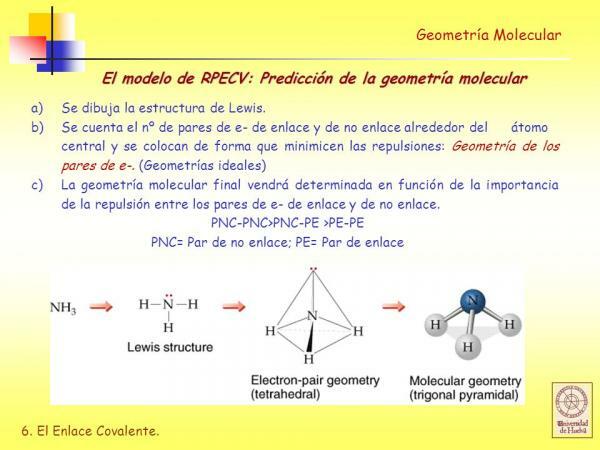
Cunoașteți structura Lewis a moleculei.
Înainte de a putea utiliza Metoda RPECV este necesar să știm ce este Structura lui Lewis moleculei și pentru aceasta trebuie să știți mai întâi ce este configurație electronicădin stratul Valencia a diferiților atomi care alcătuiesc molecula.
Prin urmare, înainte de a putea determina geometria unei molecule, este necesar să efectuați câțiva pași anteriori:
- LA. Obțineți configurațiile electronice a diferiților atomi care alcătuiesc molecula.
- B. Determinați numărul de electroni ai carcasei de valență a fiecăruia dintre atomi. Electronii din carcasa de valență sunt electronii pe care atomul îi poate folosi pentru a forma legături.
- C. Deduceți structura lui Lewis luând în considerare câte electroni are fiecare atom în învelișul său de valență.
Imagine: Slideplayer
Model de repulsie a perechii de electroni a carcasei de valență (RPECV)
În Structuri Lewis fiecare dintre atomii legați, trebuie să îndeplinească regula octetului. Când un atom îndeplinește regula octetului, acesta este înconjurat de patru perechi de electroni care pot fi electroni care fac parte dintr-un legătură (perechi de electroni care leagă) sau perechi de electroni care nu participă la formarea de legături (perechi de electroni nu legare).
După cum vom vedea, odată ce structura Lewis a unei molecule este determinată, deduce-o geometria folosind modelul de repulsie al perechilor de electroni ai valvele este foarte uşor.
Conform acestui model de reprezentare, liganzii (X) și perechile de electroni fără legătură (E) sunt dispuse în jurul atomului central (A), astfel încât distanța dintre ele să fie maximă. Suma liganzilor și a perechilor de electroni fără legătură (X + E) determină tipul de geometrie a moleculei.
X + E = 2
Geometrie liniară
AX2: Molecula formată din doi atomi de ligand atașați la un atom central
Exemplu: hidrură de beriliu (BeH2).
X + E = 3
Geometria planului triunghiular (triunghi echilateral)
AX3: Molecula formată din trei atomi atașați la un atom central
Exemple: Unele cloruri precum borul sau aluminiul (BCl3, AlCl3)
Geometrie unghiulară (unghi de 120º)
AX2E: Molecula cu un atom central atașat la doi liganzi și o pereche de electroni care nu sunt legați.
Exemple: clorură de staniu (II) (Sn2Cl)
X + E = 4
Geometrie tetraedrică
AX4: Molecule cu un atom central cu patru liganzi dispuși în legături astfel încât liganzii să fie au la vârfurile diagonalelor opuse un cub al cărui centru este însuși atomul central.
Exemple: Molecule precum metan (CH4), clorură de siliciu (SiCl4) sau tetraclorură de carbon (CCl4) prezintă această geometrie.
Geometria piramidei trigonale
AX3E: Molecule cu 3 liganzi și 1 pereche de electroni solitari în care sunt aranjați formarea atomilor celor trei liganzi baza unei piramide cu o bază triunghiulară în care atomul central se află în vârful superior al numitului piramidă
Exemple: una dintre moleculele care are această geometrie este amoniacul (NH3).
Geometrie unghiulară (unghi de 109º)
AX2E2: Cei doi liganzi și atomul central sunt dispuși formând un unghi de 109º
Exemple: Apa (H2O) este una dintre moleculele care au această geometrie.
Geometrie liniară
AX3: Deoarece există un singur ligand atașat la atomul central, geometria este liniară.
Exemplu: fluorură de hidrogen sau acid fluorhidric (HF).
X + E = 5
Geometrie bipiramidală trigonală
AX5: Molecula are geometria a două piramide opuse, cu o bază triunghiulară comună ambelor. Atomul central este dispus în centru, iar liganzii sunt localizați la vârfuri.
Exemplu: Pentaclorură de fosfor (PCl5)
Geometrie disenoidală
AX4E: În acest tip de geometrie, atomii dobândesc un aranjament care seamănă cu structura unui balansoar.
Exemplu: fluorură de tetra sulf (SF4).
T geometrie
AX3E2: Moleculele au forma literei T, cu liganzii la capetele literei și atomul central în punctul în care se întâlnesc cele două linii care o formează.
Exemplu: trifluorură de clor (ClF3)
Geometrie liniară
AX2E3: În acest caz, cei trei atomi ai moleculei sunt dispuși în linie cu atomul central într-o poziție intermediară.
Exemplu: Difluorură de xenon (F2Xe)
X + E = 6
Geometrie octaedrică
AX6: Acest tip de moleculă are o structură care seamănă cu un octaedru în care atomul central ar ocupa centrul figurii geometrice și cei șase liganzi fiecare dintre vârfurile sale.
Exemplu: hexafluorură de sulf (SF6)
Piramida de bază pătrată
AX5E: În acest caz, atomii formează o figură în care atomul central ocupă centrul bazei, iar liganzii cele cinci vârfuri ale figurii.
Exemplu: Pentafluorură de brom (BrF5)
Geometria pătratului plan
AX4E2: Atomii dobândesc un aranjament în formă pătrată, în care atomul central ocupă centrul figurii și liganzii fiecare dintre vârfurile sale.
Exemplu: ion tetrafluorură de xenon (XeF4)

Dacă doriți să citiți mai multe articole similare cu Geometrie moleculară: definiție și exemple, vă recomandăm să introduceți categoria noastră de Atomul.
Bibliografie
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Chimie de bază. Madrid: Uned