Care sunt VALENȚELE AZOTULUI

Azotul este un element chimic foarte important în viața noastră, Și la bine și la rău. Este principalul gaz din atmosferă, este prezent în sol și este o macromoleculă foarte importantă pentru majoritatea ființelor vii. De asemenea, face parte din compuși de mare importanță industrială precum amoniacul, propulsorii sau explozivii.
Ce se întâmplă este că valența și starea sa de oxidare sunt diferite în funcție de compus. În această lecție de la un PROFESOR vom vorbi despre care sunt valențele azotului. Dacă sunteți interesat să aflați despre acest element chimic, vă va plăcea acest articol!
Index
- Ce este azotul și proprietăți
- Care sunt valențele azotului?
- Nomenclatura compușilor azotați
- Compuși importanți de azot
- Efectele azotului asupra sănătății
- Efectele asupra mediului ale azotului
Ce este azotul și proprietăți.
Azotul este un element chimic cu simbolul N. cu un număr atomic de 7, o greutate atomică de 14,0067 și găsit în stare gazoasă în condiții normale. Azotul molecular reprezintă 78% din volumul aerului uscat și, prin urmare, este principalul gaz prezent în atmosferă.
Această concentrație mare de azot în atmosferă rezultă din acțiunea electrică din atmosferă, prin fixarea azotului atmosferic acțiunea bacteriană, acțiunea chimică în industrii și eliberarea de azot prin descompunerea materiei organice sau prin combustie. În compușii săi care formează starea combinată, azotul se găsește în diferite stări.
Este un element de mare importanță pentru ființe vii, întrucât Face parte din toate proteinele atât vegetale cât și animale și mulți alți compuși organici. Azotul formează legături puternice cu alți atomi, cum ar fi azotul și alții, datorită capacității sale de a formează legături triplePrin urmare, compușii de azot posedă o cantitate mare de energie.
Azotul este format din doi izotopi:
- N14 (foarte majoritar)
- N15 și diverși izotopi radioactivi, care sunt produși în timpul reacțiilor nucleare.
Este un element de mare interes în industria chimică și în compușii utilizați în agricultură. De asemenea, se folosește la becurile cu lămpi cu incandescență și atunci când este nevoie de o atmosferă relativ inertă.
Azotul în forma sa elementară este ușor reactiv la temperaturi obișnuite cu cele mai comune substanțe, în timp ce la temperaturi ridicate. la temperaturi la care reacționează cu multe substanțe, precum titan, aluminiu, siliciu, bor, beriliu, calciu, litiu sau crom, cu oxigenul (O2) la care reacționează formează oxizi precum protoxidul de azot (NO) și cu hidrogen la temperaturi și presiune ridicate pentru a forma un compus industrial foarte important, cum ar fi amoniacul.
Sursa imagine: Monographs.com
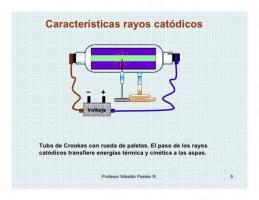
Care sunt valențele azotului?
The valențele unui element chimic este el număr din electroni ce lipsesc sau ce ar trebui să dea pentru a completa ultimul nivel electronic.
The atomi au de obicei 7 niveluri sau straturi unde sunt localizați electronii, cu 1 fiind cel mai interior și 7 fiind cel mai exterior. La rândul lor, există diferite subniveluri, numite s, p, d și f. Într-un atom, electronii umplu diferitele niveluri în funcție de energiile lor, umplând mai întâi nivelurile inferioare de energie și apoi trecând la un nivel superior.
La nivelul cel mai exterior al atomului se mai numeste ca coajă de valență iar electronii aflați în acest înveliș se numesc electroni de valență. Acești electroni sunt responsabili de formarea legăturilor și de reacțiile chimice care sunt posibile. cu alți atomi, adică sunt electronii responsabili de proprietățile fizice și chimice ale a element.
Diferitele moduri în care se combină azotul îi vor conferi o valență (cunoscută și sub numele de stare de oxidare). Azotul nu este capabil să-și extindă învelișul de valență așa cum fac alte elemente din grupul său. Valențele sale posibile sunt -3, +3 și +5. Starea de valență a azotului variază în funcție de compusul din care face parte. Celelalte elemente din familia azotului au și ele aceste stări de oxidare și sunt fosforul (P), antimoniul (Sb), bismutul (Bi), moscoviul (Mc) și arsenul (As).
Formarea compușilor chimici cu azot poate fi explicată urmând teoria legăturii de valență, conform configurației electronice a fiecărei stări de oxidare a azotului. Pentru a o explica, se ia în considerare numărul de electroni din învelișul său de valență și câți lipsesc pentru a ajunge la configurația electronică a unui gaz nobil.

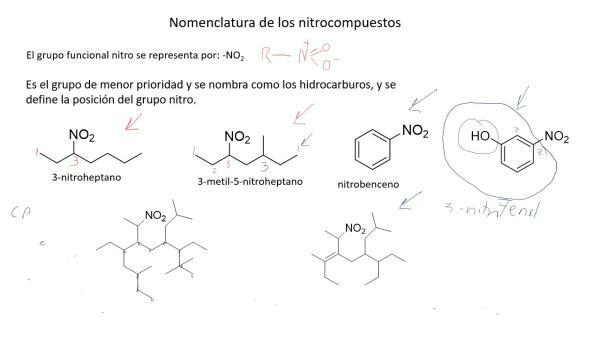
Nomenclatura compușilor azotați.
Compușii cu azot sunt complecși din punct de vedere chimic iar nomenclatura tradițională nu a fost suficientă pentru a le numi și identifica cu ușurință, așa că pe care Uniunea Internațională de Chimie Pură și Aplicată (IUPAC) a creat (tot din cauza altor factori) A nomenclatura sistematică în care compuşii sunt denumiţi după numărul de atomi care îi formează.
Această nomenclatură este potrivită în special pentru denumirea oxizilor de azot. Astfel, oxidul de azot se numește monoxid de azot și protoxid de azot (NO), monoxid de dinazot (N2O).
Pe lângă această nomenclatură, în 1919, chimistul german Alfred Stock a dezvoltat o metodă în care au fost denumiți compușii in functie de starea de oxidare, reprezentate cu cifre romane si intre paranteze. În acest fel, oxidul de azot s-ar numi oxid de azot (II) și protoxid de azot, oxid de azot (I).
Imagine: Youtube
Compuși importanți de azot.
Azotul este capabil să se lege de diferite elemente și să formeze un număr mare de compuși datorită numărului mare de stări posibile de oxidare. În cazul azotului molecular, valența acestuia este 0 prin definiție.
Una dintre cele mai comune stări de oxidare este -3. În această stare de oxidare, azotul formează compuși precum amoniacul (NH3), ionul de amoniu (NH4).-), nitrili (C≡N), imine (C=N-R) sau amine (R3N). Când azotul este în starea de oxidare -2, în învelișul său de valență rămân 7 electroni. Numărul impar de electroni din învelișul său de valență facilitează formarea legăturilor de punte între doi atomi de azot. În această stare, azotul formează hidrazone (C=N-N-R2) și hedrazine (R2-N-N-R2). În starea de oxidare -1, 6 electroni rămân în învelișul de valență și se formează compuși precum hidroxilamina (R2NOH) și compușii azo (RN=NR).
Când azotul atinge stări pozitive de oxidare, Azotul se leagă de atomii de oxigen pentru a forma oxizi, oxiacizi sau oxisăruri. În starea de oxidare +1, azotul rămâne cu 4 electroni în învelișul său de valență. Astfel, avem exemple precum oxidul de dinazot (N2O), cunoscut în mod popular sub numele de gaz de râs, și compușii azotați (R=NO). În starea +2 avem oxid de azot sau oxid de azot (NO), care este un gaz incolor care este generat în timpul reacției metalelor cu acidul azotic diluat. Acest compus are un radical liber foarte instabil care poate reacționa cu oxigenul pentru a forma un poluant atmosferic important, cum ar fi dioxidul de azot (NO2).
În starea +3, compuși precum nitritul se formează în soluție bazică (NO2–) sau acid azot în soluție acidă (HNO2). Ambii sunt agenți oxidanți care pot da naștere la oxid nitric (NO) sau pot fi agenți reducători pentru a forma ionul de nitrat. Alți compuși sunt trioxidul de dinazot (N2O3) și gruparea nitro (R-NO2). În starea +4 avem dioxid de azot (NO2) sau dioxid de azot. Acesta este un gaz de culoare maro care este produs prin reacția multor metale cu acidul azotic concentrat pentru a forma tetroxid de dinazot (N2O4). La +5, putem găsi nitrați sau acid azotic, care sunt agenți oxidanți în soluții acide.
In cele din urma, Există compuși în care azotul se află în diferite stări de oxidare.. Aceștia sunt compuși precum nitrozilazida sau trioxidul de dinazot.
Imagine: Ambientum
Efectele azotului asupra sănătății.
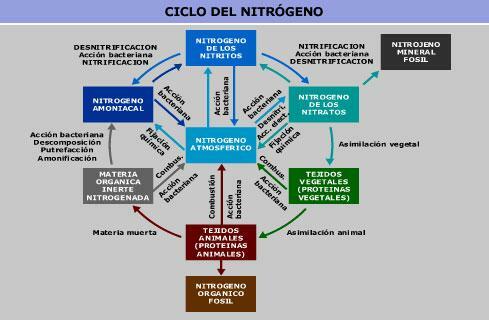
Azotul molecular este principala componentă gazoasă a gazului atmosferic. În apă și sol, îl putem găsi sub formă de nitrat și nitriți. Toți acești compuși se interconectează între ei în ciclul azotului.
Acțiunea omului a modificat concentrațiile de nitrați și nitriți pe uscat, în principal prin aplicarea de gunoi de grajd cu nitrați pe sol. În plus, concentrația de nitrați și nitriți în sol și apă este crescută de azotul emis de industrii prin ciclul azotului. Acest lucru ar putea duce, de asemenea, la creșterea azotului în apa potabilă.
The efectele nitraților și nitriților asupra sănătății umane acestea ar putea fi:
- Nitrații au un efect negativ asupra activității glandei tiroide
- Nitrații scad stocarea vitaminei A
- Atât nitrații, cât și nitriții produc nitrozamine, care este o cauză frecventă a cancerului
- Nitritul reacţionează cu hemoglobina, determinând o scădere a capacităţii de transport de oxigen a sângelui.
- Oxidul de azot (NO) este un mesager fundamental în corpul uman, provocând relaxare musculare, beneficiază în sistemul cardiovascular sau exercită efecte de semnalizare asupra celulelor sistem imunitar. Aceste efecte sunt deja exploatate în multiple aplicații medicinale, precum medicamentele împotriva infarctului sau Viagra.
Efectele asupra mediului ale azotului.
Adăugarea de nitrați și nitriți la îngrășăminte determină o creștere a concentrațiilor acestora în mediu, precum și diferite procese industriale. Mulți dintre acești compuși pot scăpa în atmosferă și pot reacționa cu oxigenul, dând naștere la poluanți atmosferici care favorizează creșterea efectului de seră.
La rândul lor, nitrații și nitriții produc, de asemenea, efecte adverse în apa dulce și în mediul marin, afectând negativ acest ecosistem și specia care o locuiesc. De asemenea, concentrațiile acestor compuși azotați în apa potabilă cresc drastic, exercitându-și astfel efectele negative asupra sănătății umane.
Dacă doriți să citiți mai multe articole similare cu Care sunt valențele azotului, vă recomandăm să intrați în categoria noastră de Atomul.
Bibliografie
- Mayz-Figueroa, J. (2004). Fixarea biologică a azotului. UDO Agricultural Scientific Journal, 4(1), 1-20.
- Celaya-Michel, H. și Castellanos-Villegas, A. ȘI. (2011). Mineralizarea azotului în solul zonelor aride și semiaride. Terra Latinoamericana, 29(3), 343-356.
- Cárdenas-Navarro, R., Sánchez-Yáñez, J. M., Farías-Rodríguez, R. și Peña-Cabriales, J. J. (2004). Aportul de azot în agricultură. Chapingo Magazine Horticulture Series, 10(2), 173-178.