Узнайте, где находятся электроны в АТОМе

Электроны - это субатомные частицы, которые вращаются вокруг ядра атома в электронном облаке, называемом электронная кора. В этом уроке УЧИТЕЛЯ мы увидим где электроны внутри атомной структуры, а также поведение электронов в различных состояниях атомов (основа и состояние возбуждения), когда атомы образуют одноатомные ионы и когда электроны не связаны с каким-либо конкретным атомом.
Индекс
- Что такое электроны и где они находятся?
- Как узнать, что такое валентные электроны?
- Электроны атома: основное состояние и состояние возбуждения
- Прирост или потеря электронов: образование одноатомных ионов
- Электроны в движении: электрический ток
Что такое электроны и где они находятся?
В электроны я знаю найти внутри принадлежащий атомыкоторые являются наименьшими единицами, составляющими материю. Атомы неделимы, и их структура и состав определяют характеристики материалов.
Атомы состоят из трех типов субатомные частицы:
- Протоны: частицы с массой и положительным зарядом
- Нейтроны: частицы с массой и без электрического заряда
- Электроны: Это безмассовые и отрицательно заряженные частицы.
Протоны и нейтроны являются частью ядра атома, поэтому атомное ядро он концентрирует всю массу и положительный заряд атома.
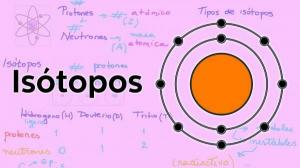
С другой стороны, электроны вращаются вокруг ядра по определенным орбитам, образуя электронное облако, называемое электронная кора. Электронная оболочка атома концентрирует весь отрицательный заряд и не имеет массы.
Электронные орбиты
Орбиты, которые электроны описывают вокруг атомного ядра, являются определенными заранее заданными орбитами. То есть пути электронов вокруг атомного ядра не случайны. Внутри электронной оболочки существует лишь несколько возможных орбит для электронов; в то время как другие орбиты запрещены. определяется как атомная орбиталь та область вокруг ядра, в которой вероятность найти электрон больше 90%.
На каждой из этих возможных орбиталей электрон, который циркулирует по ней, приобретает определенную энергию, которая увеличивается по мере удаления орбиталей от ядра. Орбитали сгруппированы в разные уровни энергии (n) или слоев, всего существует 7 энергетических уровней, причем n = 1 - это самый низкий энергетический уровень и тот, который находится ближе всего к ядру атома. На каждом уровне или слое энергии есть разные типы орбиталей (s, p, d и f орбитали).
Расположение, в котором электроны распределены по различным энергетическим уровням и орбиталям в атоме, известно как электронная конфигурация.

Изображение: Slideplayer
Как узнать, что такое валентные электроны?
Физические и химические характеристики атомов определяются их составом и, особенно, электронной конфигурацией их атомов. внешний слой (валентный слой).
Химические элементы - это различные типы атомов, которые существуют и определяются их атомным номером (Z) и их массовым числом (A).
- Атомный номер (Z): количество протонов атомного элемента, которое равно количеству электронов, если атом нейтрален.
- Массовое число (А): количество частиц с массой атомного элемента, то есть сумма частиц атомного ядра (протоны плюс нейтроны).
Каждому элементу присваивается химический символ который представляет это, и набор всех из них отправляется в научном документе, который упорядочивает в соответствии с их атомными номерами и группирует их в соответствии с их характеристиками в семейства и группы аффинных типов: Периодическая таблица.

Электроны атома: основное состояние и состояние возбуждения.
в основное состояние, который определяется как состояние минимальной энергии и максимальной стабильности атома; электроны не распределяются случайным образом по разным атомным орбиталям, а занимают разные орбитали упорядоченным образом, всегда заполняя, во-первых, орбитали с наименьшей энергией.
В этом состоянии атом имеет такое же количество электронов, что и протоны, а положительный и отрицательный заряды компенсируют друг друга, поэтому атом в целом нейтрален (у него нет чистого заряда).
Однако электроны может прыгать с одной орбиты на другую испускание или поглощение энергии. Когда электроны атома не заполняют орбитали упорядоченным образом, говорят, что атом находится в возбужденное состояние. В возбужденном состоянии один или несколько электронов занимают орбитали с более высокой энергией, оставляя пустые орбитали с более низкой энергией. В возбужденном состоянии атомы очень нестабильны и стремятся быстро вернуться в основное состояние.
При смене орбитального электрон излучает или поглощает энергию. Если электрон перескочит с орбиты с более низкой энергией на орбиту с более высокой энергией, атом поглотит энергию; в то время как если прыжок совершается в противоположном направлении (с орбитали с более высокой энергией на орбиталь с более низкой энергией), атом высвобождает энергию.

Потеря или получение электронов: образование одноатомных ионов.
Электроны в самой внешней оболочке электронной коры (называемой валентной оболочкой) - это электроны, которые они могут покинуть атом или они могут быть включены для этого. Таким образом, атом может приобретать или терять электроны.
В нейтральный атом количество протонов, присутствующих в ядре, равно количеству электронов, составляющих его электронную оболочку. То есть количество положительных зарядов равно количеству отрицательных зарядов. Когда происходит прирост или потеря электронов, атомы образуют одноатомные ионы.
Типы одноатомных ионов
По заряду иона различают два типа:
- Одноатомные катионы: атомы, потерявшие один или несколько электронов, так что часть положительного заряда ядра не компенсируется. Таким образом, атом приобретает чистый положительный заряд.
- Одноатомные анионы: атомы, которые приобрели один или несколько электронов, так что количество электронов больше, чем количество протонов в ядре, так что атом приобретает чистый отрицательный заряд.

Электроны в движении: электрический ток.
Когда электроны они не связаны ни с каким атомом в частности, они перемещаются через свободное пространство между атомами. Это независимое движение электронов формирует поток электрического заряда, который может проходить через определенные материалы (проводящие и полупроводниковые материалы).
Так, например, происходит в случае электрический ток который обеспечивает питание зданий, транспортных средств и т. д.
Если вы хотите прочитать больше статей, похожих на Где находятся электроны?, рекомендуем вам войти в нашу категорию Атом.
Библиография
Алехандрина Гальего Пико, Роза Мо Гарсинуньо Мартинес, Мо Хосе Морсилло Ортега, Мигель Анхель Васкес Сегура. (2018) Основы химии. Мадрид: Унед