ВСЕ свойства АТОМА

Изображение: SlideShare
Хотя мы не можем увидеть их невооруженным глазом, атомы являются частью всей материи нашей планеты. Вся материя состоит из атомов, которые группируются в химические элементы, молекулы, соединения и т. Д. Атом определяется как наименьшая базовая единица материи, обладающей свойствами химического элемента. Каждый химический элемент определяется типом атома, из которого он состоит, поэтому последний вопрос: какими свойствами обладает атом? В этом уроке от УЧИТЕЛЯ мы рассмотрим свойства атома которые делают каждый атом характерным химическим элементом.
Индекс
- Что такое атом?
- Атомный номер, массовое число и изотопы
- Плотность, еще одно свойство атома
- Ионный радиус и радиус Вандерволла
- Энергия ионизации
Что такое атом?
Прежде чем приступить к анализу свойств атома, важно лучше понять, о чем он. В атом представляет собой единицу, состоящую из трех субатомных частиц: протоны, нейтроны и электроны. Они организованы в ядро и кору.
- В основной Это сделано протоны Y нейтроны, который находится в центре атома и отвечает за большую часть веса атома; протоны заряжены положительно, а нейтроны нейтральны, поэтому ядро заряжено положительно.
- В Кора Он образован электроны, которые представляют собой небольшие отрицательно заряженные частицы, которые вращаются вокруг ядра, образуя орбиты (как у планет), но никогда не падают на ядро атома. Кора атома отвечает за взаимодействие с корой других атомов, поскольку она расположена снаружи атомов.
Различные атомы состоят из протонов, нейтронов и электронов, одинаковых во всех химических элементах. Так что же делает разные химические элементы? Количество протонов, нейтронов и электронов из которых состоят атомы каждого элемента, различается, и это, в свою очередь, делает каждый элемент разным. Особенности или другие.

Изображение: SlideShare
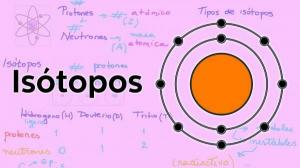
Атомный номер, массовое число и изотопы.
Первые три характеристики напрямую связаны с количеством частиц, составляющих атом каждого элемента.
В атомный номер (Z) указывает количество протонов, составляющих ядро атома. Так, например, в ядрах всех атомов железа будет 26 протонов. Кроме того, если нам не сообщают иное, химические элементы находятся в нейтральном состоянии, то есть положительный (протоны) и отрицательный (электроны) заряд одинаковы, поэтому все они также будут иметь 26 электроны.
В массовое число или же атомный вес (A) указывает общее количество протонов и нейтронов, составляющих ядро атома. Как мы уже указывали ранее, вес электронов практически ничтожен по сравнению с весом электронов. протонов и нейтронов, поэтому массовое число косвенно указывает на вес рассматриваемого атома. Продолжая пример с железом, если вы посмотрите периодическую таблицу элементов, вы увидите, что вес атомный элемент этого элемента равен 55,85, что означает, что все атомы этого элемента будут иметь этот масса.
Наконец, изотопы химического элемента - это варианты одного и того же атома (то есть, они имеют один и тот же атомный номер), но другое массовое число, то есть другое количество нейтронов. Большинство химических элементов имеют более одного природного изотопа, причем элементом с наибольшим количеством стабильных изотопов является олово (Sn), которое имеет 10 различных природных изотопов.

Изображение: ConceptDefinition.de
Плотность - еще одно свойство атома.
В плотность атома - это количество единиц массы (u.m.a) элемента, которое присутствует в определенном объеме пространства. Плотность любого вещества обозначается греческой буквой «Ро» (пишется р) а его единицы согласно международной системе единиц (СИ) - килограммы на кубический метр (кг / м3). В случае столь малых химических элементов, грамм на кубический сантиметр (г / см3).
Чтобы рассчитать плотность атома (атомная плотность), мы должны были бы учитывать массу атома и его объем. Хотя большая часть массы атома находится в его ядре, объем должен составлять от того, насколько велик атом, и, следовательно, количество электронных орбиталей будет играть роль важный. Принимая во внимание эти свойства и их тенденцию в периодической системе, мы можем заметить, что плотность увеличивается по мере того, как мы увеличиваемся в группе, а также увеличивается по мере приближения к центральной части принадлежащий периодическая таблица.

Изображение: YouTube
Ионный радиус и радиус Вандерволла.
В ионный радиус это радиус, который ион элемента имеет в ионно-кристаллическом состоянии. В этом состоянии ионы расположены так близко друг к другу, что внешние электронные орбитали контактируют друг с другом.
С другой стороны, радиус вандерваллов Это расстояние, на котором два атома находятся друг от друга из-за отталкивания отрицательных зарядов, существующих между электронами каждого из атомов. Радиус Вандерволла - это радиус воображаемой твердой сферы, используемой для моделирования атома, поэтому в повседневной практике он практически не используется.
В отличие от того, что происходит с плотностью или массой, эти два свойства тесно связаны. с объемом атома, то есть они больше связаны с количеством электронов в нем, чем с основной.

Изображение: SlidePlayer
Энергия ионизации.
Наконец, еще одно свойство атома - это энергия ионизации, свойство, которое сообщает нам энергию, необходимую для отделения электрона в его основном состоянии (кроме аниона или катиона) атома элемента в газообразном состоянии, но его также можно определить как силу, с которой электрон связывается с другими молекулы. Это свойство очень интересно, поскольку позволяет нам получить приблизительное представление о способность реагировать атома определенного химического элемента. Энергия ионизации выше по мере удаления электронов, поэтому для элемента существует энергия первая ионизация, вторая энергия ионизации, и так далее, и они становятся все больше и больше.
Как и в предыдущем случае, это свойство также тесно связано с количеством орбиталей рассматриваемый элемент, поскольку чем меньше у него орбиталей, тем больше будет стоить удаление электронов из атома. определенный.

Изображение: SlidePlayer
Если вы хотите прочитать больше статей, похожих на Свойства атома, рекомендуем вам войти в нашу категорию Атом.