Struktura in značilnosti atomov

Slika: SlidePlayer
Atomi so del našega sveta. Vsa snov je sestavljena iz atomov, zato je pomembno, da bolje razumemo, iz česa so in kakšne so njihove funkcije. V tej lekciji UČITELJA vam bomo povedali, kaj zgradba atoma in značilnosti. Če želite izvedeti več o delcih, ki sestavljajo vse snovi, nadaljujte z branjem tega članka.
Kazalo
- Kaj so atomi?
- Struktura atoma
- Glavne značilnosti atoma
- Kaj so izotopi?
- Kako najdemo atome v naravi?
Kaj so atomi?
The atom je najmanjša enota, na katero lahko snov razdelimo ne da bi pri tem izgubil svoje kemijske lastnosti, torej lastnosti kot kemični element. Atom je izvor vsega, kar je mogoče videti ali se dotakniti, od zvezd do jutranjega zajtrka.
Če odmislimo izgubo njegovih kemijskih lastnosti, lahko rečemo, da je atom sestavljen iz različnih delcev, imenovanih subatomski delci. Obstajajo tri vrste subatomskih delcev -protoni, nevtroni in elektroni- z različnimi značilnostmi.
Ti delci so združeni v različno število, da tvorijo kemične elemente (kisik, ogljik itd.), Vendar se bodo vedno porazdelili po fiksni strukturi.

Slika: Google Sites
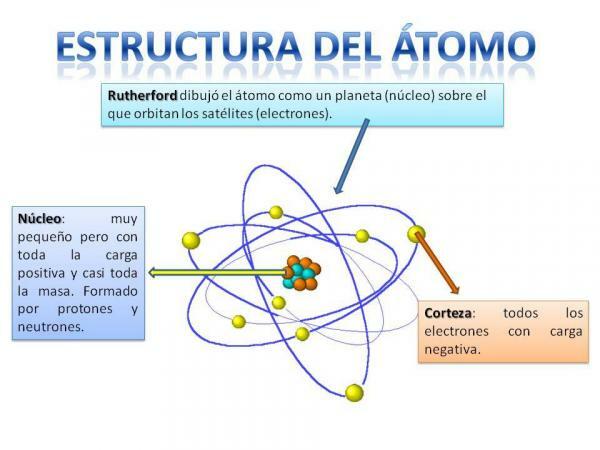
Struktura atoma.
Struktura atoma je fiksna, to pomeni, da imamo lahko različne vrste atomov (atom vodika, atom kisika itd.), vendar so njihovi subatomski delci vedno organizirani na podoben način kot planetarni sistem.
Zagotovo se boste spomnili, kako je organiziran sončni sistem: Sonce je v središču in okoli njega od tega se planeti vrtijo in opisujejo različne orbite, nekatere bližje in druge bolj oddaljene od Sonce Pri atomih je v središču jedro, z obliko, podobno robidnici in je sestavljen iz nevtroni in protoni.
Okoli jedra je Korteks kar je območje, skozi katerega elektroni. Prej so mislili, da elektroni opisujejo določene orbite, podobno kot to počnejo planeti, čeprav je zdaj ve, da te orbite niso tako natančno opredeljene in so bolj podobne območjem, na katerih se bomo bolj verjetno znašli elektroni.
Slika: REA - načrt Ceibal
Glavne značilnosti atoma.
Za nadaljevanje te lekcije o strukturi atoma in značilnostih je pomembno, da se osredotočimo na elemente, zaradi katerih je atom takšen.
In za to moramo odgovoriti na to vprašanje: Zakaj se vsi atomi odločijo, da se uredijo na tak način? Odgovor je preprost: posledica je električne privlačne sile. Jedro atoma sestavljajo nevtroni, ki nimajo električnega naboja, in protoni, ki imajo pozitiven električni naboj. elektroni pa imajo negativen električni naboj, zato obstaja podobna privlačna sila med jedrom in elektroni ustvarjen med obema magnetnima poloma, vendar ni dovolj močan, da bi elektroni "padli" na jedro.
To je bolje razumeti, če upoštevamo velikost jedra: če bi imel atom na primer dimenzijo nogometnega stadiona, bi jedro imelo dimenzijo žoge v sredini s terena Koliko privlačne sile bi morala narediti nogometna žoga, da bi nanjo padle tribine stadiona!
Funkcija nevtronov
Zdaj se morda sprašujete in kakšno vlogo imajo nevtroni? Kljub temu da nimajo električnega naboja, imajo nevtroni veliko vlogo v atomu: prispevajo 99% mase. Če vam pomaga, da se spomnite, lahko rečemo, da je atom podoben skupini treh prijateljev: težki nevtron, pozitivni proton in negativni elektron, ki kroži okoli kroga nevtrona in elektrona.
Gibanje elektronov
Na tej točki želim, da se vrnemo k nečemu, kar smo imeli v črnilnici: orbite, ki jih elektroni opisujejo okoli jedra. To smo že povedali elektroni se vrtijo okoli jedra kot to počnejo planeti okoli Sonca, nekateri bližje kot drugi, zakaj to počnejo? Elektroni se v eni ali drugi lupini vrtijo glede na energijo, ki jo potrebujejo za odmik od jedra, torej tisti elektroni, ki so bližje jedru, nimajo zadostna sila za odmik od jedra, medtem ko imajo tiste v najbolj oddaljenih lupinah (orbitalah) skorje več energije in so se lahko oddaljile od jedra. jedro. Poleg tega je v vsaki orbitali največja moč 8 elektronov (pravilo okteta).
Delci atoma
Vrnili se bomo k drugemu pristopu, ki smo ga že storili, vendar nismo pojasnili: atomi so sestavljeni iz nevtroni, protoni in elektroni, ki se vedno kombinirajo po isti strukturi jedra in skorje, vendar to storijo v različnem številu, da tvorijo različne kemične elemente. Kako lahko dobimo toliko elementov, ki združujejo samo 3 vrste delcev? Za kemijske elemente, ki ste jih kdaj videli v periodični tabeli, je značilno, da imajo določeno atomsko število.
The atomska številka (Z) Pove nam število protonov v jedru te vrste atomov, ki je v normalnih pogojih enako številu elektronov. Tako bodo na primer vsi atomi, ki imajo 6 protonov (Z = 6), atomi ogljika in bodo imeli enake kemijske lastnosti; atomi s 5 protoni (Z = 5) bodo atomi bora z enakimi kemijskimi lastnostmi in drugačnimi od atomov ogljika. Atomskega števila vam ni treba zamenjati z atomsko težo oz masno število (A), kar je vsota teže nevtronov in protonov (teža elektronov je glede na težo celotnega jedra zanemarljiva).

Slika: SlidePlayer
Kaj so izotopi?
V naravi najdemo različne "podvrste" elementov, izotopi. Prepričan sem, da ste v nekem trenutku že slišali za ogljik 14, radioaktivni izotop ogljika, ki se med drugim uporablja za določanje starosti fosilov. Izotopi so dva atoma z enakim številom protonov (enako atomsko število), vendar različno število nevtronov, (različna atomska masa). Izotope istega elementa običajno imenujemo z imenom elementa, ki mu sledi njegova atomska masa.
V našem primeru sta oba izotopa ogljika, zato imata atomsko število 6 (Z = 6), vendar ogljik 12 ("normalni" ogljik) ima atomsko težo 12 v primerjavi z atomsko težo ogljika 14 14. Izotopi istega elementa imajo zelo podobne kemijske in fizikalne lastnosti. Pri ogljiku 14 gre za razliko od ogljika 12 za radioaktivni izotop, ki je prisoten v vseh elementih, ki vsebujejo ogljik, vključno z živimi bitji.
S tem zaključimo to lekcijo o strukturi atoma in značilnostih. Upamo, da vam je bila v pomoč.

Slika: Vaša opravila
Kako najdemo atome v naravi?
Atome lahko najdemo ločeno, vendar je najbolj normalno, da jih najdemo združeni v skupine poklical molekul.
Molekule lahko sestavljajo atomi istega elementa (kot je molekula kisika, sestavljena iz dveh atomov kisik) ali po skupinah z atomi različnih elementov (dva atoma vodika in en kisik tvorita molekulo Voda). Te skupine elementov imenujemo molekule, ki jih lahko nato kombiniramo med seboj in tvorijo različne vedno bolj zapletene skupine glede na njihovo reaktivnost in kemijsko afiniteto za vir kemijske povezave.
Če želite prebrati več podobnih člankov Struktura in značilnosti atomov, priporočamo, da vnesete našo kategorijo Atom.



